Lý thuyết: Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ
Chuyên đề Hóa học 12 Lý thuyết: Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ. Chắc chắn tài liệu sẽ giúp các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ
I. Kim loại kiềm và hợp chất
1. Kim loại kiềm
- Thuộc nhóm IA, đứng đầu mỗi chu kì (trừ chu kì 1).
- Tính chất vật lí: mềm, khối lượng riêng nhỏ, nhiệt độ nóng chảy thấp.
- Có 1e ở lớp ngoài cùng (ns1).
- Tính chất hóa học: Có tính khử mạnh nhất trong tất cả các kim loại (tác dụng với nước, axit, phi kim).
M → M+ + 1e
Một số phương trình minh họa:
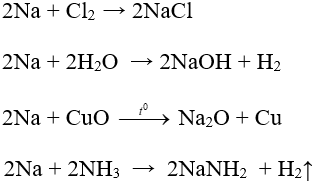
- Phương pháp điều chế: điện phân hợp chất nóng chảy.
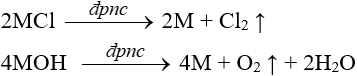
2. Một số hợp chất quan trọng của kim loại kiềm.
- NaOH: có tính kiềm mạnh; được dùng để nấu xà phòng, chế phẩm nhuộm tơ nhân tạo,…
- NaHCO3: có tính lưỡng tính, bị phân hủy bởi nhiệt; dùng được trong công nghiệp dược phẩm và thực phẩm.
- Na2CO3: là muối của axit yếu; được dùng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy sợi…
- KNO3: có tính oxi hóa mạnh khi đun nóng; được dùng làm phân bón, chế tạo thuốc nổ.
II. Kim loại kiềm thổ và hợp chất
1. Kim loại kiềm thổ
- Thuộc nhóm IIA, đứng sau nguyên tố kim loại kiềm trong mỗi chu kì.
- Tính chất vật lí: tương đối mềm, nhiệt độ nóng chảy thấp.
- Có 2e lớp ngoài cùng (ns2).
- Tính chất hóa học: có tính khử mạnh (tác dụng với phi kim, dung dịch axit, nước):
M → M2+ + 2e
Một số phương trình minh họa:
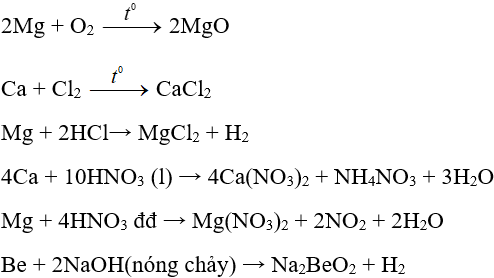
- Phương pháp cơ bản là điện phân muối nóng chảy của chúng.
CaCl2 → Ca + Cl2↑
MgCl2 → Mg + Cl2↑
2. Một số hợp chất quan trọng của kim loại kiềm thổ
- Ca(OH)2: là một bazơ mạnh, dung dịch Ca(OH)2 có tính chất chung của một bazơ tan; được dùng trong xây dựng, trồng trọt và sản xuất clorua vôi.
- CaCO3: bị nhiệt phân hủy; bị hòa tan bởi CO2 trong nước ở nhiệt độ thương; được dùng nhiều trong ngành công nghiệp, xây dựng, thực phẩm, …
- Ca(HCO3)2: có tính lưỡng tính, bị phân hủy bởi nhiệt.
- CaSO4: tùy theo lượng nước kết tinh trong muối, có ba loại.
+ CaSO4.2H2O (thạch cao sống): bền ở nhiệt độ thường; được dùng để sản xuất xi măng.
+ CaSO4.2H2O hoặc CaSO4.5H2O (thạch cao nung); được dùng để đúc tượng, trang trí nội thất,…
+ CaSO4 (thạch cao khan): không tan và không tác dụng với nước.
3. Nước cứng
- Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+, nước mềm là nước chứa ít hoặc không chứa các ion trên.
- Phân loại:
+ Nước cứng có tính cứng tạm thời: chứa Ca(HCO3)2 và Mg(HCO3)2.
+ Nước cứng có tính cứng vĩnh cửu: chứa các muối clorua và sunphat của canxi và magie.
+ Nước cứng có tính cứng toàn phần: có cả tính cứng tạm thời và tính cứng vĩnh cửu.
- Cách làm mềm nước cứng: phương pháp kết tủa và phương pháp trao đổi ion.
Lưu ý: Ion HCO3- trong muối của kim loại kiềm và kiểm thổ có tính lưỡng tính:
HCO3- + H+ → H2O + CO2
HCO3- + OH- → H2O + CO32-
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 1)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 2)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 3)
- Lý thuyết Kim loại kiềm: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Lý thuyết Kim loại kiềm thổ: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Lý thuyết Nhôm: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Lý thuyết: Một số hợp chất quan trọng của kim loại kiềm
- Lý thuyết: Một số hợp chất quan trọng của kim loại kiềm thổ
Trên đây VnDoc đã giới thiệu tới các bạn Lý thuyết: Luyện tập tính chất của kim loại kiềm, kim loại kiềm thổ. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








