Xác định công thức phân tử Amine, Amino Acid
Cách xác định công thức của amine và amino acid là nội dung quan trọng trong chương trình Hóa học 12, thường xuất hiện trong các đề kiểm tra và đề thi THPT Quốc gia. Việc nắm vững công thức tổng quát, phương pháp giải và các bước thiết lập công thức giúp học sinh dễ dàng xử lý nhiều dạng bài tập khác nhau. Bài viết cung cấp hệ thống lý thuyết, ví dụ minh họa và bài tập amine – amino acid có lời giải chi tiết, hỗ trợ học sinh tự học hiệu quả và đạt điểm cao trong các kỳ thi.
Bài tập xác định công thức amine, amino acid có lời giải
A. Cách xác định công thức của amine
I. Phản ứng đốt cháy của Amine
1. Phản ứng cháy Amine no đơn chức
![]() \(2C_nH_{2n+3}N\;\;\;+\;\frac{6n+3\;}2O_2\;\rightarrow\;2nCO_2\;+\;(2n+3)H_2O+\;N_2\)
\(2C_nH_{2n+3}N\;\;\;+\;\frac{6n+3\;}2O_2\;\rightarrow\;2nCO_2\;+\;(2n+3)H_2O+\;N_2\)
Số mol amin = 2/3 (nH2O - nCO2) và
![]() \(\frac{2n}{2n+3}=\frac{n_{CO_2}}{n_{H_2O}}\Rightarrow n=?\)
\(\frac{2n}{2n+3}=\frac{n_{CO_2}}{n_{H_2O}}\Rightarrow n=?\)
2. Phản ứng cháy Amine thơm
![]() \(2C_nH_{2n\;–\;5}N\;+\;\frac{6n-5}2\;O_2\;\rightarrow\;2nCO_2\;+\;(2n-5)H_2O\;+N_2\)
\(2C_nH_{2n\;–\;5}N\;+\;\frac{6n-5}2\;O_2\;\rightarrow\;2nCO_2\;+\;(2n-5)H_2O\;+N_2\)
3. Amine không no đơn chức có 1 liên kết đôi (CnH2n+1N)
![]() \(2C_nH_{2n+1}N\;\;\;+\;\frac{6n+1}2\;O_2\;\rightarrow\;2nCO_2\;+\;(2n+1)H_2O\;+\;N_2\)
\(2C_nH_{2n+1}N\;\;\;+\;\frac{6n+1}2\;O_2\;\rightarrow\;2nCO_2\;+\;(2n+1)H_2O\;+\;N_2\)
Số mol amin = 2 (nH2O – nCO2) và
![]() \(\frac{2n}{2n+1}=\frac{n_{CO_2}}{n_{H_2O}}\)
\(\frac{2n}{2n+1}=\frac{n_{CO_2}}{n_{H_2O}}\)
4. Phản ứng cháy Amine tổng quát
![]() \(C_xH_yN_t+(x+\frac y4)O_2\rightarrow xCO_2+\frac y2H_2O+\frac t2N_2\)
\(C_xH_yN_t+(x+\frac y4)O_2\rightarrow xCO_2+\frac y2H_2O+\frac t2N_2\)
LƯU Ý:
Khi đốt cháy một amine ta luôn có: nO2 phản ứng = nCO2 + 1/2nH2O
Khi đốt cháy một amine ngoài không khí thì: nN2 sau pư = nN2 sinh ra + nN2 có sẵn trong không khí
5. Câu hỏi bài tập minh họa
Bài tập ví dụ minh họa
Ví dụ 1. Khi đốt cháy hoàn toàn một amine đơn chức X, thu được 9,29625 lít khí CO2, 1,549375 lít khí N2 (các thể tích khí đo ở đktc) và 10,125 gam H2O. Công thức phân tử của X là (cho H = 1, O = 16)
Đáp án hướng dẫn giải chi tiết
Gọi công thức phân tử của amine đơn chức là CxHyN
Ta có phương trình tổng quát:
![]() \(C_xH_yN_t+(x+\frac y4)O_2\rightarrow xCO_2+\frac y2H_2O+\frac t2N_2\)
\(C_xH_yN_t+(x+\frac y4)O_2\rightarrow xCO_2+\frac y2H_2O+\frac t2N_2\)
nCO2 = 9,29625 : 24,79 = 0,375 mol
nH2O = 10,125:18 = 0,5625 mol
nN2 = 1,549375:24,79 = 0,0625 mol
namine = 2nN2 = 0,125 mol
![]() \(x = \frac{n_{CO_{2} } }{n_{amine} } = \frac{0,375}{0,125} = 3; y = \frac{2n_{H_{2}O}}{n_{amine}} = \frac{2.0,5625}{0,125} = 9\)
\(x = \frac{n_{CO_{2} } }{n_{amine} } = \frac{0,375}{0,125} = 3; y = \frac{2n_{H_{2}O}}{n_{amine}} = \frac{2.0,5625}{0,125} = 9\)
Vậy công thức hóa học của amine là: C3H9N
Ví dụ 2: Đốt cháy hoàn toàn m gam một amine đơn chức X bằng lượng không khí vừa đủ thu được 1,76 gam CO2; 1,26 gam H2O và N2 (đkc). Tìm CTPT của X.
Đáp án hướng dẫn giải chi tiết
Đặt Công thức tổng quát của amine đơn chức là CxHyN
Ta có ![]() \(n_{CO_2}\) = 0,04(mol);
\(n_{CO_2}\) = 0,04(mol); ![]() \(n_{H_2O}\) = 0,07(mol)
\(n_{H_2O}\) = 0,07(mol)
⇒ x : y = nH: nC = 7 : 2⇒ X là C2H7N
Vậy Công thức cấu tạo của X là C2 H5 NH2
Ví dụ 3: Đốt cháy hoàn toàn 5,4 gam một amine X đơn chức, bậc 1 trong lượng vừa đủ không khí (O2 chiếm 20% thể tích, còn lại là N2). Dẫn sản phẩm khí qua bình đựng nước vôi trong dư thu được 24 gam kết tủa và có 46,1094 lít (đkc) một chất khí duy nhất thoát ra. X là:
Đáp án hướng dẫn giải chi tiết
![]() \(2C_nH_{2n+3}N\hspace{0.278em}\hspace{0.278em}\hspace{0.278em}+\hspace{0.278em}\frac{6n+3\hspace{0.278em}}2O_2\hspace{0.278em}\rightarrow\hspace{0.278em}2nCO_2\hspace{0.278em}+\hspace{0.278em}(2n+3)H_2O+\hspace{0.278em}N_2\)
\(2C_nH_{2n+3}N\hspace{0.278em}\hspace{0.278em}\hspace{0.278em}+\hspace{0.278em}\frac{6n+3\hspace{0.278em}}2O_2\hspace{0.278em}\rightarrow\hspace{0.278em}2nCO_2\hspace{0.278em}+\hspace{0.278em}(2n+3)H_2O+\hspace{0.278em}N_2\)
Ca(OH)2 dư nên ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{CaCO_3}\) = 0,24 ⇒ nC = 0,24
\(n_{CaCO_3}\) = 0,24 ⇒ nC = 0,24
Trong X đặt nH = a và nN = b ⇒ ![]() \(n_{H_2O}\) = 0,5a và
\(n_{H_2O}\) = 0,5a và ![]() \(n_{N_2}\) sản phẩm = 0,5b mol
\(n_{N_2}\) sản phẩm = 0,5b mol
mX = a + 14b + 0,24.12 = 5,4 (1)
nN2 tổng = 1,86 ⇒ nN2 không khí = 1,86 – 0,5b
nN2 tổng = 1,86 ⇒ nN2 không khí = 1,86 – 0,5b
=> nO2 = nN2/4 = 0,465 - 0,125b
Bảo toàn O: 2nO2 = 2nCO2 + nH2O
⇒2. (0,465 – 0,125b) = 0,24.2 + 0,5a (2)
(1) và (2) ⇒ a = 0,84 và b = 0,12
⇒ nc : nH : nN = 0,24 : 0,84 : 0,12 = 2 : 7 : 1
X đơn chức nên X là C2H7 N
Ví dụ 4: Đốt cháy hoàn toàn V lít hơi một amine X bằng một lượng oxi vừa đủ tạo ra 8V lít hỗn hợp gồm khí carbonic, khí nitrogen và hơi nước (các thể tích khí và hơi đều đo ở cùng điều kiện). Amine X tác dụng với Nitrous acid ở nhiệt độ thường, giải phóng khí nitrogen. Chất X là:
Đáp án hướng dẫn giải chi tiết
![]() \(C_{x}H_{y}N_{z} + \frac{(x+y)}{4} O_{2} → xCO_{2} + \frac{y}{2} H_{2}O + \frac{z}{2} N_{2}\)
\(C_{x}H_{y}N_{z} + \frac{(x+y)}{4} O_{2} → xCO_{2} + \frac{y}{2} H_{2}O + \frac{z}{2} N_{2}\)
Tự chọn nX = 1 mol
=> nCO2 + nH2O + nN2 = x + y/2 + z/2 = 8
⇒ 2x + y + z = 16
⇒ x = 3; y = 9; z = 1 là nghiệm thỏa mãn.
X + HNO2 → N2 nên X là amine bậc 1.
⇒ CH3-CH2-CH2-NH2
II. Xác định phân tư khối bằng phương pháp phổ khối lượng
Lập công thức phân tử
- Một hợp chất hữu cơ có công thức phân tử là CxHyNz. Thiết lập công thức đơn giản nhất bằng cách lập tỉ lệ x : y : z ở dạng số nguyên tối giản p : q : t.
- Phân tích định lượng, ta được tỉ lệ phần trăm các nguyên tố trong phân tử.
![]() \(x:y:z=\frac{\%m_{C} }{12}:\frac{\%m_{H} }{1}:\frac{\%m_{N} }{14}=p:q:r(=n_{C} :n_{H}:n_{O})\)
\(x:y:z=\frac{\%m_{C} }{12}:\frac{\%m_{H} }{1}:\frac{\%m_{N} }{14}=p:q:r(=n_{C} :n_{H}:n_{O})\)
- Mối quan hệ giữa công thức phân tử và công thức đơn giản nhất: CxHyNz = (CpHqNt)n Trong đó: p, q r là các số nguyên tối giản, x, y, z, n là số nguyên dương.
- Khi biết phân tử khối, xác định được giá trị n, từ đó suy ra công thức phân tử.
Xác định phân tư khối bằng phương pháp phổ khối lượng
- Phương pháp phổ khối lượng được sử dụng để xác định khối lượng phân tử các hợp chất hữu cơ.
- Đối với các hợp chất đơn giản, thường mảnh có giá trị m/z lớn nhất ứng với mảnh ion phân tử [M+] và giá trị này bằng giá trị phân tử khối của chất nghiên cứu.
Phổ hồng ngoại và nhóm chức:
- Phương pháp phổ hồng ngoại (viết tắt là IR) là phương pháp vật lý rất quan trọng và phổ biến để nghiên cứu cấu tạo phân tử hợp chất hữu cơ.
| Loại hợp chất | Liên kết hấp thụ | Số sóng (cm-1) |
 |
N – H | 3500 – 3200 |
Ví dụ 1. Kết quả phân tích nguyên tố của hợp chất amine thơm X có phần trăm khối lượng các nguyên tố như sau: %C = 78, 51%;%H = 8, 41%;% N = 13, 08% . Từ phổ khối lượng (MS) xác định được phân tử khối của X bằng 107. Xác định công thức phân tử của X.
Hướng dẫn trả lời
Gọi công thức phân tử của X là CxHyNz
Ta có:
![]() \(x:y:z=\frac{78, 51}{12} :\frac{8, 41}{1} :\frac{13, 08}{14}=6, 54 : 8, 41: 0, 93 = 7 : 9 :1\)
\(x:y:z=\frac{78, 51}{12} :\frac{8, 41}{1} :\frac{13, 08}{14}=6, 54 : 8, 41: 0, 93 = 7 : 9 :1\)
CTĐG: C7H9N
Từ phổ khối lượng, X có phân tử khối bằng 107 ⇒ (C7H9N)n = 107
Mà 107n = 107 ⇒ n = 1. CTPT: C7H9N.
Ví dụ 2. Vị tanh của cá, đặc biệt là cá mè, là do các amine gây ra, trong đó có amine X. Phân tích nguyên tố đối với X thu được kết quả: %C = 61, 02% ; %H = 15, 25%;% N = 23, 73% (về khối lượng). Từ phổ khối lượng, xác định được phân tử khối của X bằng 59. Bằng các phương pháp khác, thấy phân tử X có cấu trúc đối xứng cao. Viết công thức cấu tạo của X.
Hướng dẫn trả lời
Gọi công thức phân tử của X là CxHyNz
Ta có
![]() \(x:y:z=\frac{61, 02}{12} :\frac{15, 25}{1} :\frac{23, 73}{14}=5, 1 : 15, 25: 1, 7 = 3 : 9 :1\)
\(x:y:z=\frac{61, 02}{12} :\frac{15, 25}{1} :\frac{23, 73}{14}=5, 1 : 15, 25: 1, 7 = 3 : 9 :1\)
CTĐG: C3H9N
Từ phổ khối lượng, X có phân tử khối bằng 59 ⇒ (C3H9N)n = 59 Mà 59n = 59 ⇒ n = 1. CTPT: C3H9N.
CTCT của X là (CH3)3N.
B. Cách xác định công thức của amino acid
I. Dựa vào phản ứng đốt cháy Amino Acid
Đặt CTTQ CxHyOzNt
Phương trình đốt cháy amino axit tổng quát
![]() \(C_xH_yO_zN_t+\frac{2x+y/2-z}2O_2\overset{t^o}{\rightarrow x}CO_2\;+\;\frac y2H_2O+\frac t2N_2\)
\(C_xH_yO_zN_t+\frac{2x+y/2-z}2O_2\overset{t^o}{\rightarrow x}CO_2\;+\;\frac y2H_2O+\frac t2N_2\)
Bảo toàn nguyên tố C = nCO2/namino acid
H = 2nH2O/namino acid
Bảo toàn khối lượng: maa = mC + mH + mO/aa + mN
Bảo toàn nguyên tố oxygen: nO/aa + 2nO2 = 2nCO2 + nH2O
![]() \(x:y:z:t=\frac{m_C}{12}:\frac{m_H}1:\frac{m_O}{16}:\frac{m_N}{14}=n_{CO_2}:2n_{H_2O}:\frac{m_O}{16}:2n_{N_2}\)
\(x:y:z:t=\frac{m_C}{12}:\frac{m_H}1:\frac{m_O}{16}:\frac{m_N}{14}=n_{CO_2}:2n_{H_2O}:\frac{m_O}{16}:2n_{N_2}\)
![]() \(x:y:z:t=\frac{\%C}{12}:\frac{\%H}1:\frac{\%O}{16}:\frac{\%N}{14}\)
\(x:y:z:t=\frac{\%C}{12}:\frac{\%H}1:\frac{\%O}{16}:\frac{\%N}{14}\)
II. Xác định phân tư khối bằng phương pháp phổ khối lượng
Ví dụ 1: Kết quả phân tích nguyên tố của một a-amino acid X như sau: %C = 46, 60% ; % H = 8, 74%; % N = 13, 59% (về khối lượng); còn lại là oxygen. Bằng phổ khối lượng (MS) , xác định được phân tử khối của X bằng 103. Xác định công thức cấu tạo của X.
Hướng dẫn trả lời
Gọi công thức phân tử của X là CxHyOzNt
![]() \(x:y:z=\frac{46, 6}{12} :\frac{8, 74}{1} :\frac{31, 07}{16}:\frac{13, 59}{14}=3, 88 : 8, 74: 1, 94:0,97 = 4 : 9 :2:1\)
\(x:y:z=\frac{46, 6}{12} :\frac{8, 74}{1} :\frac{31, 07}{16}:\frac{13, 59}{14}=3, 88 : 8, 74: 1, 94:0,97 = 4 : 9 :2:1\)
CTĐG: C4H9O2N
Từ phổ khối lượng, X có phân tử khối bằng 103 ⇒ (C4H9O2N)n = 103 Mà 103n = 103 ⇒ n = 1. CTPT: C4H9O2N
D. Bài tập vận dụng xác định công thức phân tử Amin, Amino Axit
Câu 1: Đốt cháy hoàn toàn 6,2 gam một amine no, đơn chức phải dùng hết 11,1555 lít khí oxygen (đkc). Công thức của amine đó là:
A. C4H11N.
B. CH5N.
C. C3H9N.
D. C2H7N.
Công thức amin: CnH2n +3 N
![]() \(\frac{6n+3}4.n_{amine}\hspace{0.278em}=n_{O_2}\)
\(\frac{6n+3}4.n_{amine}\hspace{0.278em}=n_{O_2}\)
![]() \(\frac{6n+3}4.\frac{62}{14n+17}=\frac{10,08}{22,4}\)
\(\frac{6n+3}4.\frac{62}{14n+17}=\frac{10,08}{22,4}\)
⇒ n = 1 ⇒ CH5N
→ Đáp án B
Câu 2: Đốt cháy hoàn toàn amin đơn chức X bằng O2, thu được 1,2395 lít N2, 9,916 lít CO2 (các khí đo ở đktc) và 8,1 gam H2O. Công thức phân tử của X là:
A. C3H9N.
B. C4H11N.
C. C4H9N.
D. C3H7N.
CTTQ của amine đơn chức là CxHyN
nN = 2nN2 = 0,1(mol)
nC = nCO2 = 0,4(mol)
nH = 2nH2O = 0,9(mol)
Ta có tỉ lệ:
nC : nH : nN = 0,4 : 0,9 : 0,1 = 4 : 9 : 1
Vậy công thức amine là C4 H9N
→ Đáp án C
Câu 3: Khi đốt cháy hoàn toàn một amine đơn chức X, thu được 9,29625 lít khí CO2; 1,549375 lít khí N2 (các thể tích khí đo ở đkc) và 10,125 gam H2O. Công thức phân tử của X là?
A. C4H9N
B. C3H9N.
C. C4H11N
D. C3H7N.
nCO2 = 0,375 mol
nN2 = 0,0625 ⇒ nN = 0,125 mol
nH2O = 0,5625 mol ⇒ nH = 1,125 mol
nC : nH : nN = 0,375 : 0,125 : 1,125 = 3 : 9 : 1 ⇒ C3H9N
→ Đáp án B
Câu 4: Đốt cháy hoàn toàn 2 amin no đơn chức đồng đẳng kế tiếp cần 2,479 lít oxygen thu được 1,2395 lít CO2 (đkc). Công thức phân tử của 2 amin là:
A. C2H5NH2, C3H7NH2
B. CH3NH2, C2H5NH2
C. C4H9NH2, C5H11NH2
D. C3H7NH2, C4H9NH2
Công thức chung: CnH2n+3N
CnH2n+3N + (6n+3)/4 O2 → nCO2 + (2n+3)/2 H2O + 1/2N2
nO2 = 0,1 mol; nCO2 = 0,05 mol
Bảo toàn O:
2nO2 = 2nCO2 + nH2O => nH2O = 0,1 mol
⇒ nH2O - nCO2 = 1,5 namine = 3nN2
⇒ namine = 1/30 mol; nN2 = 1/60 mol
Bảo toàn khối lượng:
mamine = mCO2 + mH2O+ mN2 − mO2 = 1,2667 g
⇒ Mamine = 38 ⇒ 14n + 17 = 38 ⇒ n = 1,5
⇒ Công thức 2 amine no đơn chức đồng đẳng kế tiếp là: CH3NH2 (31) và C2H5NH2 (45)
→ Đáp án B
Câu 5: Đốt cháy một amin đơn chức no (hở) thu được tỉ lệ số mol CO2 : H2 O là 2 : 5. Amin đã cho có tên gọi nào dưới đây?
A. Dimethylamine.
B. Methylamine.
C. Trimethylamine.
D. Izopropylamine
Ta có: nC : nH = nCO2 : 2nH2O = 2 : 10 = 1 : 5
⇒ Công thức phân tử : CH5N methylamine.
→ Đáp án B
Câu 6: Đốt cháy hoàn toàn một Amino acid A thì thu được CO2 và N2 theo tỉ lệ thể tích là 4:1. Biết phân tử A chỉ chứa 1 nhóm amine bậc I. Công thức cấu tạo của A là:
A. CH3CH(NH2)COOH
B. H2NCH2COOH
C. H2NCH2CH2COOH
D. CH3NHCH2COOH
Có nC : nN = nCO2 : 2nN2 = 4 : 2 = 2 : 1
A chỉ chứa 1 nguyên tử N trong phân tử suy ra số nguyên tử C = 2
⇒ Công thức phân tử của A là C2H5NO2, CTCT: H2NCH2COOH
→ Đáp án B
Câu 7: Đốt 1 Amino acid X no mạch hở chứa 1 nhóm amino và 1 nhóm carboxyl bằng 1 lượng không khí vừa đủ thu được hỗn hợp khí và hơi có tỉ khối so với H2 là 14,3167. Công thức của Amino acid là:
A. C5H11O2N
B. C3H7O2N
C. C4H9O2N
D. C2H5O2N
![]() \(C_{n}H_{2n+1} NO_{2} + \frac{6n-3 }{4} O_{2} → nCO_{2} + \frac{2n+1}{2} H_{2} O + \frac{1}{2} N_{2}\)
\(C_{n}H_{2n+1} NO_{2} + \frac{6n-3 }{4} O_{2} → nCO_{2} + \frac{2n+1}{2} H_{2} O + \frac{1}{2} N_{2}\)
Tự chọn nX = 1mol
=> nO2 = (6n-3)/4 mol
⇒ nN2 (không khí) = 4nO2 = 6n – 3 mol
Sau phản ứng thu được: CO2 (n), H2O (n + 0,5) và N2 (6n – 2,5)
Khí sau phản ứng có M = 14,317 .2 = 28,634
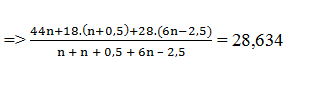
→ n = 4: công thức phân tử C4H9NO2
→ Đáp án C
Câu 8: Đốt cháy hoàn toàn Amino acid X cần vừa đủ 30,0 gam khí oxygen. Cho hỗn hợp sản phẩm cháy vào bình đựng dung dịch NaOH đặc dư thấy khối lượng bình tăng 48,75 gam và còn thoát ra 3,09875 lít N2 (đktc). Vậy CTPT của X có thể là:
A. C4H9O2N
B. C2H5O2N
C. C3H7O2N
D. C3H9O2N
![]() \(n_{N_2}\)= 0,125 mol
\(n_{N_2}\)= 0,125 mol
⇒ mX = 22,25g
Giả sử phân tử X có k nguyên tử N
Bảo toàn N ⇒ nX = 2. ![]() \(\frac{n_{N_{2} } }{k}\) =
\(\frac{n_{N_{2} } }{k}\) = ![]() \(\frac{0,25}{k} mol\)
\(\frac{0,25}{k} mol\)
⇒ MX = 89k
⇒ k = 1 và MX = 89
Công thức phân tử X là C3H9NO2
→ Đáp án D
Câu 9. Đốt cháy hoàn toàn một Amino acid X (phân tử có 1 nhóm NH2) thu được 17,6 gam CO2 và 2,479 lít N2. Công thức phân tử của X là
A. C3H7NO2.
B. C4H9NO2.
C. C2H7NO2.
D. C2H5NO2.
Đáp án hướng dẫn giải chi tiết
nCO2 = 17,6:44 = 0,4 (mol)
nN2(đktc) = 2,24 :22,4 = 0,1 (mol)
Bảo toàn nguyên tố "N": nX = 2nN2 = 2.0,1 = 0,2 (mol)
Tất cả đáp án đều có 2 oxi nên đặt công thức Amino acid có dạng: CxHyO2N: 0,1 (mol)
⇒ x = nCO2: nX = 0,4 : 0,2 = 2
⇒ y chỉ có thể bằng 5 thỏa mãn, y bằng 7 không thỏa mãn được
Vậy công thức của Amino acid là C2H5NO2
Câu 10. Đốt cháy hoàn toàn một amine chưa no, đơn chức một liên kết C=C thu được CO2 và H2O theo tỉ lệ mol nCO2 : nH2O = 8 : 9. Công thức phân tử amin là
A. C3H7N.
B. C2H7N.
C. C3H9N.
D. C4H9N
Đáp án hướng dẫn giải chi tiết
Gọi công thức tổng quát của amine: CnH2n+2-2k+1N.
Do amin có chứa 1 liên kết C=C nên k = 1 => công thức phân tử amine: CnH2n+1N
CnH2n+1N → nCO2 + (n + 0,5) H2O
Ta có: nCO2/nH2O=n/(n + 0,5) = 8/9 ⇒ n = 4
Vậy công thức phân tử của amine là C4H9N.
Câu 11. Đốt cháy hoàn toàn amine đơn chức A, thu được 8,30465 lít CO2; 1,549375 lít N2 (đktc) và 10,125 gam H2O. Công thức phân tử của A là:
A. C2H7N.
B. C4H9N.
C. C3H9N.
D. C3H7N.
Đáp án hướng dẫn giải chi tiết
Ta có: nCO2 = 0,335 mol; nN2 = 0,0625 mol; nH2O = 0,5625 mol
Bảo toàn nguyên tố N ta có: nN (A) = 2.nN2 = 0,125 mol
Bảo toàn nguyên tố C ta có: nC (A) = nCO2 = 0,335 mol
Bảo toàn nguyên tố H ta có: nH (A) = 2.nH2O = 2.0,5625 = 1,125 mol
Gọi công thức phân tử của amin X là CxHyNz (x, y, z là số nguyên).
Ta có: x : y : z = nC : nH : nN = 0,335 : 1,125 : 0,125 = 3 : 9 : 1
Do amin đơn chức nên công thức phân tử của amin X là C3H9N.
Câu 12. Cho 2,1 gam hh X gồm 2 amine no, đơn chức, kế tiếp nhau trong dãy đồng đẳng phản ứng hết với dung dịch HCl (dư), thu được 3,925 gam hỗn hợp muối. Công thức của 2 amine trong hỗn hợp X là
A. C3H7NH2 và C4H9NH2.
B. CH3NH2 và C2H5NH2.
C. CH3NH2 và (CH3)3N.
D. C2H5NH2 và C3H7NH2.
Đáp án hướng dẫn giải chi tiết
Gọi CT của X là CnH2n+1NH2
CnH2n+1NH2 + HCl → CnH2n+1NH3Cl
Áp dụng tăng giảm khối lượng ta có:
nHCl = namine= 3,925−2,136,5 = 0,05mol
→ Mamine = 2,1/0,05 = 42→14n+17 = 42→ n= 1,786
mà 2 amine đồng đẳng kế tiếp → CH3NH2 và C2H5NH2










