Bài tập chuyên đề hình thí nghiệm Hóa học
VnDoc mời thầy cô cùng các bạn học sinh tham khảo tài liệu Bài tập chuyên đề hình thí nghiệm Hóa học, chắc chắn bộ tài liệu sẽ là nguồn thông tin hữu ích để phục vụ các bạn học sinh rèn luyện chuyên đề hình thí nghiệm Hóa học một cách tốt nhất. Mời các bạn cùng tham khảo chi tiết tại đây nhé.
Bài tập hình vẽ thí nghiệm hóa học
Bài tập chuyên đề hình thí nghiệm Hóa học
A. LƯU Ý CHUNG
I. Về dụng cụ và hóa chất
Trong bất kì hình vẽ nào ở SGK (đặc biệt năm 2017 là SGK lớp 12) cần chú ý một số điểm sau:
- Hóa chất sử dụng là những chất gì? Hóa chất có tác dụng gì?
- Dụng cụ lắp đặt: Nằm nghiêng hay ngang? Vai trò của nó trong bộ thí nghiệm? Phản ứng xảy ra trong dụng cụ chứa hóa chất là gì?
- Điều kiện phản ứng: Đặc, loãng, rắn, có cần đun nóng hay không?
- Thu khí bằng cách nào...
II. Điều chế một số chất khí trong phòng thí nghiệm Chất lỏng + Chất rắn
| Khí | Chất phản ứng | Phương trình phản ứng | |
| Chất lỏng | Chất rắn | ||
| H2 | dung dịch HCl, dung dịch H2SO4 loãng | Zn, Fe | Zn + H2SO4 loãng → ZnSO4 + H2 |
| CO2 | dung dịch HCl | CaCO3 | 2HCl + CaCO3 → CaCl2 + CO2 + H2O |
| C2H2 | H2O | CaC2 | 2H2O + CaC2 → C2H2 + Ca(OH)2 |
| Cl2 |
HCl (đặc) HCl (đặc) |
MnO2 KMnO4 |
MnO2 + 4HCl (đặc) → MnCl2 + Cl2 + 2H2O 2KMnO4 + 16HCl (đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O |
| HCl | dd H2SO4 đặc | NaCl | NaCl + H2SO4 |
| O2 | dd H2O2 | MnO2 (xt) | 2H2O2 |
| H2S | dd HCl | FeS | FeS + 2HCl → FeCl2 + H2S |
| SO2 | dd H2SO4 | Na2SO3 | Na2SO3+ H2SO4 → Na2SO4 + SO2↑ + H2O |
| HNO3 | dd H2SO4 đặc | NaNO3 | NaNO3 + H2SO4 |
Chất lỏng + Chất lỏng
| Khí | Chất phản ứng | Phương trình phản ứng | |
| Chất lỏng | Chất rắn | ||
| N2 | dung dịch NH4Cl bão hòa | dung dịch NaNO2 bão hòa | NH4Cl + NaOH → NH3 + H2O + NaCl |
| CO | HCOOH | H2SO4 đặc | HCOOH |
| C2H4 | C2H5OH | H2SO4 đặc, xt | C2H5OH |
Lưu ý: Khi điều chế khí ethylene
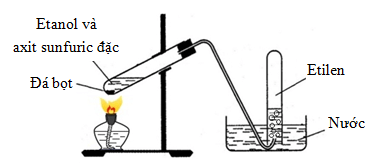
Khí etilen sinh ra có lẫn CO2 và SO2. Để khí không lẫn tạp chất thì cần phải dẫn qua bông tẩm NaOH đặc để loại bỏ 2 khí này.
Phản ứng xảy ra ở 170°C nên phải cho đá bọt vào để hỗn hợp không sôi đột ngột và quá mạnh sẽ trào chất lỏng ra ngoài, không đảm bảo an toàn khi làm thí nghiệm.
Chất rắn + Chất rắn (ống nghiệm chứa hóa chất nằm ngang, miệng hơi chúc xuống)
| Khí |
Chất phản ứng | Phương trình phản ứng | |
| Chất rắn | Chất rắn | ||
| O2 | KClO3 | MnO2 xt | 2KClO3 |
| KMnO4 | 2KMnO4 |
||
| NH3 | NH4Cl | Ca(OH)2 hoặc NaOH |
2NH4Cl(r) + Ca(OH)2 (r) |
| CH4 | CH3COONa | NaOH/CaO (vôi tôi xút) |
CH3COONa + NaOH |
Đọc thêm:
+ Điều chế oxygen
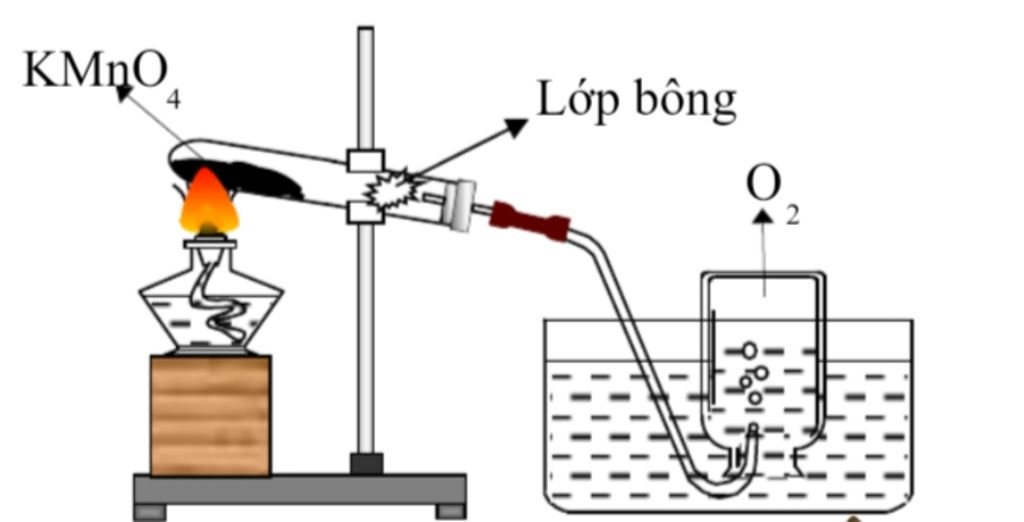
- Nếu điều chế oxi bằng nhiệt phân chất rắn thì lắp ống nghiệm sao cho miệng ống nghiệm hơi chúc xuống để đề phòng hỗn hợp có chất rắn ẩm, khi đun hơi nước không chảy ngược lại làm vỡ ống nghiệm.
Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun. - KClO3 là chất dễ gây nổ nên không nghiền nhiều mọt lúc và không nghiền lẫn với bất kì chất nào khác. Lọ đựng KClO3 không để hở nút cạnh: P, C, S nút lọ đựng KClO3 không độn giấy vào
- Từ: KMnO4 điều chế oxi tuy ít hơn từ KClO3 nhưng dễ mua không cần dùng chất xúc tác và ít
gây nguy hiểm - Khi thu khí O2, đề kiểm tra O2 đã đầy bình chưa ta đưa tàn đóm đỏ vào miệng bình thấy bùng cháy chửng tò O2 đà đầy bình
+ Điều chế NH3
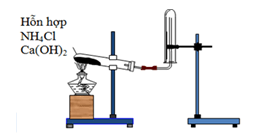
Điều chế khí ammonia trong phòng thí nghiệm
+ Làm khô khí bằng CaO. Để điều chế một lượng nhỏ NH3 thì đun nóng dung dịch NH3 đậm đặc
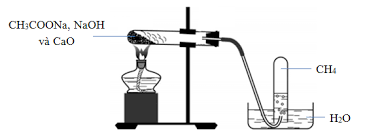
- Thu metan bằng phương pháp đẩy nước do oxi không tan trong nước.
- Phải dùng CaO mới, không dùng CaO đã rã, CH3COONa phải thật khan trước khi làm thí nghiệm.
- Nếu hỗn hợp phản ứng bị ẩm thì phản ứng xảy ra chậm.Phải đun nóng bình cầu khí metan mới thoát ra không để ngọn lửa lại gần miệng ống thoát khí.
- Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun.
- Khi tháo rời thiết bị nên làm trong tủ hút và tắt hết lửa xung quanh
- Sử dụng glixerol để bôi trơn bề mặt tiếp xúc giữa thủy tinh và cao su
III. Cách thu khí.
Phải nắm vững tính chất vật lý (tính tan và tỉ khối) để áp dụng phương pháp thu khí đúng.
- Thu theo phương pháp đẩy không khí:
+ Khí không phản ứng với oxi của không khí.
+ Nặng hơn hoặc nhẹ hơn không khí (CO2, SO2, Cl2, H2, NH3...). Úp ống thu? Ngửa ống thu?
- Thu theo phương pháp đẩy nước:
+ Khí ít tan trong nước. (H2, O2, CO2, N2, CH4, C2H4, C2H2...).
- Các khí tan nhiều trong nước (khí HCl, khí NH3):
+ Ở 20oC, 1 thể tích nước hòa tan tới gần 500 thể tich khi Hydrogen chloride.
+ Ở điều kiện thường, 1 lít nước hòa tan khoảng 800 lít khí amoniac.
Lưu ý: SO2 là khí tan nhiều trong nước chứ không giống như CO2 đâu.
--------------------------------------









