Lý thuyết: Dãy điện hóa của kim loại
Chuyên đề Hóa học 12 Lý thuyết: Dãy điện hóa của kim loại. Hy vọng qua bộ tài liệu các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Hóa học 12: Lý thuyết Dãy điện hóa của kim loại
I. Khái niệm về cặp oxi hóa - khử của kim loại
1. Cặp oxi hoá - khử của kim loại
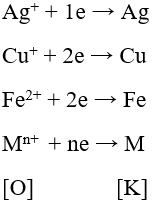
- Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá - khử của kim loại.
Ví dụ: Cặp oxi hoá - khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
2. So sánh tính chất của các cặp oxi hoá - khử
Ví dụ: So sánh tính chất của hai cặp oxi hoá - khử Cu2+/Cu và Ag+/Ag.
Cu + 2Ag+ → Cu2+ + 2Ag
Kết luận: Tính khử: Cu > Ag
Tính oxi hoá: Ag+ > Cu2+
II. Pin điện hóa của kim loại
a. Cấu tạo
Là 1 thiết bị gồm: 2 lá kim loại, mỗi lá được nhúng vào 1 dd muối có chứa cation của kim loại đó; 2 dd này được nối với nhau bằng 1 cầu muối (dd điện li trơ: NH4NO3, KNO3)
- Suất điện động của pin điện hoá (VD: Zn - Cu)
Epin = 1,10V
b. Giải thích
- Điện cực Zn (cực âm) là nguồn cung cấp e, Zn bị oxi hoá thành Zn2+ tan vào dung dịch:
Zn → Zn2+ + 2e
- Điện cực Cu (cực dương) các e đến cực Cu, ở đây các ion Cu2+ bị khử thành kim loại Cu bám trên bề mặt lá đồng.
Cu2+ + 2e → Cu
- Vai trò của cầu muối: Trung hòa điện tích của 2 dung dịch
+ Cation NH4+ (hoặc K+) và Zn2+ di chuyển sang cốc đựng dung dịch CuSO4
+ Ngược lại: các anion NO3- và SO42- di chuyển sang cốc đựng dung dịch ZnSO4.
Sự di chuyển của các ion này làm cho các dung dịch muối luôn trung hoà điện.
- Phương trình ion rút gọn biểu diễn quá trình oxi hoá-khử xảy ra trên bề mặt các điện cực của pin điện hoá:
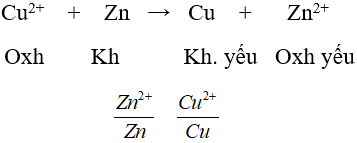
c. Nhận xét
- Có sự biến đổi nồng độ các ion Cu2+ và Zn2+ trong quá trình hoạt động của pin. Cu2+ giảm, Zn2+ tăng
- Năng lượng của phản ứng oxi hóa - khử trong pin điện hóa đã sinh ra dòng điện một chiều.
- Những yếu tố ảnh hưởng đến suất điện động của pin điện hóa như:
+ Nhiệt độ.
+ Nồng độ của ion kim loại.
+ Bản chất của kim loại làm điện cực.
- Trong pin điện hóa:
+ Cực âm (anot): xảy ra quá trình oxi hóa
+ Cực dương (catot): xảy ra quá trình khử
III. Thế điện cực chuẩn của kim loại
1. Điện cực hiđro chuẩn
Trên bề mặt điện cực hiđro xảy ra cân bằng oxi hóa - khử của cặp oxi hóa - khử 2H+/H2
Quy ước rằng: thế điện cực của điện cực hiđro chuẩn bằng 0,00 V ở mọi nhiệt độ, tức là:
![]()
2. Thế điện cực chuẩn của kim loại
Thế điện cực tiêu chuẩn của kim loại cần được chấp nhận bằng bằng suất điện động của pin tạo bởi điện cực hiđro chuẩn và điện cực chuẩn của kim loại cần đo. Có 2 trường hợp xảy ra với giá trị của thế điện cực chuẩn:
- Thế điện cực chuẩn của cặp Mn+/M là số dương nếu khả năng oxi hóa của ion Mn+trong nửa pin Mn+/M là mạnh hơn ion H+ trong nửa pin 2H+/H2
- Thế điện cực chuẩn của cặp Mn+/M là số âm nếu khả năng oxi hóa của ion Mn+ trong nửa pin Mn+/M là yếu hơn ion H+ trong nửa pin 2H+/H2
Ví dụ: Thế điện cực chuẩn của các cặp kim loại:
![]()
IV. Dãy thế điện cực chuẩn của kim loại
Dãy thế điện cực chuẩn của kim loại còn được gọi là dãy thế oxi hóa - khử chuẩn của kim loại, hoặc dãy thế khử chuẩn của kim loại.

V. Ý nghĩa của dãy thế điện cực chuẩn của kim loại
1. So sánh tính oxi hóa - khử
Trong dung môi nước, thế điện cực chuẩn của kim loại ![]() càng lớn thì tính oxi hóa của cation Mn+ càng mạnh và tính khử của kim loại M càng yếu và ngược lại
càng lớn thì tính oxi hóa của cation Mn+ càng mạnh và tính khử của kim loại M càng yếu và ngược lại
2. Xác định chiều của phản ứng oxi hóa - khử
Xác định chiều của phản ứng oxi hóa - khử cũng là sự tìm hiểu về phản ứng đó trong điều kiện tự nhiên có xảy ra hay không.
3. Xác định suất điện động chuẩn của pin điện hóa
Suất điện động chuẩn của pin điện hóa (E0pin) bằng thế điện cực chuẩn của cực dương trừ đi thế điện cực chuẩn của cực âm. Suất điện động của pin điện hóa luôn là số dương.
![]()
4. Xác định thế điện cực chuẩn của cặp oxi hóa - khử
Ta có thể xác định được thế điện cực chuẩn của cặp oxi hóa - khử khi biết suất điện động chuẩn của pin điện hóa (E0pin) và thế điện cực chuẩn của cặp oxi hóa - khử còn lại.
E0(+) = E0pin + E0(-); E0(-) = E0(+) - E0pin
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Cơ bản - phần 1)
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Cơ bản - phần 2)
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Nâng cao - phần 1)
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Nâng cao - phần 2)
- Lý thuyết Kim loại: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Lý thuyết Hợp kim: Định nghĩa, Tính chất hóa học, Tính chất vật lí, Ứng dụng
Trên đây VnDoc đã giới thiệu tới các bạn Lý thuyết: Dãy điện hóa của kim loại. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








