Mạng tinh thể kim loại gồm có
Tính chất chung của kim loại
Mạng tinh thể kim loại gồm có được VnDoc biên soạn hướng dẫn bạn đọc trả lời câu hỏi liên quan đến nội dung câu hỏi Hóa 12 Đại cương về kim loại Cũng như đưa ra các nội dung lý thuyết liên quan, từ đó bạn đọc vận dụng giải các dạng câu hỏi bài tập tương tự. Mời các bạn tham khảo.
Mạng tinh thể kim loại gồm có
A. Nguyên tử, ion kim loại và ác electron độc thân.
B. Nguyên tử, ion kim loại và các electron tự do.
C. Nguyên tử kim loại và các electron độc thân.
D. Ion kim loại và các electron độc thân.
Đáp án hướng dẫn giải bài tập
Đáp án B.
Nguyên tử, ion kim loại và các electron tự do.
Cấu tạo của kim loại
1. Cấu tạo nguyên tử
Nguyên tử kim loại có các đặc điểm sau:
+ Nguyên tử kim loại thường có ít electron ở lớp ngoài cùng.
+ Bán kính nguyên tử kim loại thường lớn hơn khá nhiều so với bán kính của nguyên tử phi kim cùng chu kì.
⇒ Các electron hóa trị ở lớp vỏ ngoài cùng của nguyên tử kim loại chịu lực hút yếu của hạt nhân.
2. Cấu tạo tinh thể
Ở nhiệt độ phòng, các đơn chất kim loại ở thể rắn và có cấu tạo tinh thể (trừ thuỷ ngân ở thể lỏng).
Trong tinh thể kim loại, các ion dương kim loại nằm ở các nút mạng tinh thể và các electron hoá trị chuyển động tự do xung quanh.
Mở rộng
|
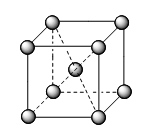
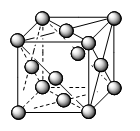
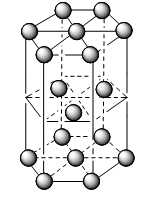
Các kiểu mạng tinh thể phổ biến của kim loại |
|||
|
Kiểu mạng tinh thể |
Mạng lập phương tâm khối |
Mạng lập phương tâm mặt |
Mạng lục phương chặt khít |
|
Cấu trúc |
 |
 |
 |
|
Độ đặc khít (%) |
68 |
74 |
74 |
|
Số phố trí |
8 |
12 |
12 |
|
Ví dụ |
Li, Na, K, Ba… |
Ca, Sr, Cu… |
Be, Mg, … |
3. Liên kết kim loại
Trong tinh thể kim loại, liên kết kim loại được hình thành do lực hút tĩnh điện giữa các electron hoá trị tự do với các ion dương kim loại ở các nút mạng.
Câu hỏi bài tập liên quan
Câu 1. Các kim loại có cấu tạo mạng tinh thể lục phương là:
A. Be, Mg, Zn
B. Be, Li, Cu
C. Be, Li, Na
D. Be, Al, Cu
Câu 2. Những kim loại nào có cấu trúc mạng lập phương tâm diện?
A. Cu, Al, Ag
B. Mg, Na, Cu
C. Na, K, Ca
D. Cu, Ca, K
Câu 3. Liên kết kim loại là liên kết được hình thành do
A. Các đôi electron dùng chung giữa 2 nguyên tử.
B. Sự nhường cặp electron chưa tham gia liên kết của nguyên tử này cho nguyên tử kia để tạo thành liên kết giữa hai nguyên tử.
C. Lực hút tĩnh điện giữa ion dương và ion âm.
D. Sự tham gia của các electron tự do giữa các nguyên tử và ion kim loại trong mạng tinh thể.
Câu 4. Dãy gồm các kim loại có cùng kiểu mạng tinh thể lập phương tâm khối là
A. Na, K , Ba
B. Mg , Ca, Ba
C. Na, K , Ca
D. Li, Na, Mg.
Câu 5. Cho các phát biểu sau về tinh thể kim loại M:
(1) Trong tinh thể kim loại M có các cation Mn+ và các electron hóa trị tự do.
(2) Trong tinh thể kim loại M có các electron hóa trị tự do chuyển động.
(3) Các cation Mn+ chuyển động tự do trong mạng tinh thể kim loại.
(4) Lực hút giữa cation Mn+ và electron hóa trị tự do trong tinh thể kim loại M phụ thuộc vào độ âm điện của kim loại M.
(5) Tinh thể kim loại M trung hòa về điện.
(6) Trong tinh thể kim loại M, các cation Mn+ và electron hóa trị tự do được phân bố theo trật tự nhất định.
Số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 1.
(1) Đúng.
(2) Đúng.
(3) Sai vì các cation kim loại trong mạng tinh thể kim loại không chuyển động tự do; chúng được sắp xếp theo một trật tự nhất định và chỉ có thể dao động quanh vị trí cân bằng của chúng.
(4) Sai vì lực hút giữa cation và electron hóa trị tự do trong kim loại chủ yếu phụ thuộc vào tính chất kim loại và mật độ electron tự do hơn là độ âm điện của kim loại.
(5) Đúng.
(6) Sai vì trong tinh thể kim loại, chỉ có các cation là sắp xếp theo trật tự nhất định trong mạng tinh thể, còn các electron hóa trị tự do thì di chuyển tự do trong tinh thể.
Câu 6. Kim loại có những tính chất vât lí chung nào sau đây?
A. Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
B. Tính dẻo, tính dẫn điện, có khối lượng riêng lớn và có ánh kim.
C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
D. Tính dẻo, có ánh kim, rất cứng.
-------------------------------










