Kim loại tác dụng với dung dịch axit
Chuyên đề Hóa học 12 Kim loại tác dụng với dung dịch axit. Nội dung tài liệu sẽ giúp các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn cùng tham khảo chi tiết tại đây nhé.
Hóa học 12: Kim loại tác dụng với dung dịch axit
VnDoc.com xin gửi tới bạn đọc bài viết Chuyên đề Hóa học 12 Kim loại tác dụng với dung dịch axit để bạn đọc cùng tham khảo. Bài viết được tổng hợp gồm có các phương pháp và ví dụ kim loại tác dung với dung dịch axit, Bên cạnh lý thuyết còn có bài tập trắc nghiệm đi kèm theo. Qua bài viết bạn đọc có thể luyện tập được cách tính thể tích của khí, cách tính khối lượng muối, cách tính dung dịch đã dùng, cách tính khối lượng của các kim loại... Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
A. Phương pháp và ví dụ kim loại tác dụng với dung dịch axit
Lý thuyết và Phương pháp giải
- Với dung dịch HCl, H2SO4 loãng
Kim loại trong cặp oxi hóa - khử có thế điện cực chuẩn âm (tức kim loại đứng trước H trong dãy hoạt động hóa học của kim loại) khử được ion hidro H+ của axit thành H2
- Với H2SO4 đặc nóng, HNO3: Hầu hết các kim loại (trừ Au, Pt) khử được S6+ và N5+ trong các axit này xuống số oxi hóa thấp hơn.
Chú ý: Nếu hỗn hợp kim loại tác dụng với hỗn hợp nhiều axit, nên viết phương trình phản ứng dạng chung (phương pháp chuyển bài toán hỗn hợp về chất tương đương) hay viết phản ứng dạng ion; viết các quá trình oxi hóa, quá trình khử, rồi vận dụng định luật bảo toàn khối lượng, bảo toàn electron để giải.
Các kiểu bài thường gặp
+) Kim loại tác dụng với 1 axit
+) Hỗn hợp kim loại tác dụng với 1 axit
+) Kim loại tác dụng với hỗn hợp axit
+) Hỗn hợp kim loại tác dụng vưới hỗn hợp axit
Ví dụ minh họa
Bài 1: Hòa tan 4,59 gam nhôm trong dung dịch HNO3 1M thu được hỗn hợp X gồm hai khí NO và N2O, tỉ khối hơi của X đối với hidro bằng 16,75. Tính:
a) Thể tích mỗi khí đo ở đktc.
b) Khối lượng muối thu được.
c) Thể tích dung dịch HNO3 đã dùng.
Hướng dẫn:
![]()
Áp dụng phương pháp sơ đồ chéo:
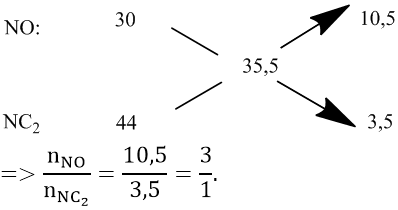
Gọi ![]() \(n_{N_2O}\) = x (mol) và nNO = 3x (mol)
\(n_{N_2O}\) = x (mol) và nNO = 3x (mol)

Áp dụng bảo toàn số mol electron: 17x = 0,51 ⇒ x = 0,03 (mol)
⇒ nNO = 0,09 (mol); ![]() \(n_{N_2}\)
\(n_{N_2}\)
a) VNO = 0,09.22,4 = 2,016 (lít); ![]() \(V_{N_2O}\) = 0,03.22,4 = 0,672 (lit)
\(V_{N_2O}\) = 0,03.22,4 = 0,672 (lit)
![]() \(n_{HNO_3}\) =
\(n_{HNO_3}\) = ![]() \(n_{HNO_3}\) bị khử +
\(n_{HNO_3}\) bị khử +![]() \(n_{HNO_3}\) tham gia tạo muối = 5x + 3.nAl = 0,03 + 3.0,17 = 0,66(mol)
\(n_{HNO_3}\) tham gia tạo muối = 5x + 3.nAl = 0,03 + 3.0,17 = 0,66(mol)
b) mmuối = n_Al.M = 0,17.213 = 36,21 (gam)
c) ![]() \(V_{HNO_3}\) đã dùng = 0,66/1 = 0,66 (lít)
\(V_{HNO_3}\) đã dùng = 0,66/1 = 0,66 (lít)
Bài 2: Cho 11 gam hỗn hợp Al và Fe vào dung dịch HNO3 loãng lấy dư thì có 6,72 lít khí NO bay ra (đktc). Tính khối lượng của mỗi kim loại trong hỗn hợp.
Hướng dẫn:
Gọi số mol Al và Fe trong hỗn hợp là x, y (mol)
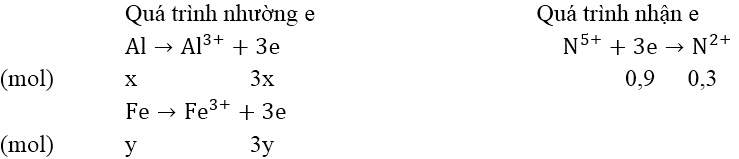
Bảo toàn electron: 3x + 3y = 0,9 ⇒ x + y = 0,3 (1)
mhỗn hợp = 27x + 56y = 11 (2)
Giải hệ phương trình (1) và (2): x = 0,2 (mol); y = 0,1 (mol)
Vậy mAl = 5,4 (gam) và mFe = 5,6 (gam)
Bài 3: Cho 3,87 gam hỗn hợp A gồm Mg và Al vào 250 ml dung dịch X chứa axit HCl 1M và H2SO4 0,5M được dung dịch B và 4,368 lít H2 (đktc)
a) Tính phần trăm khối lượng kim loại trong A.
b) Tính thể tích dung dịch C gồm NaOH 0,2M và Ba(OH)2 0,1M cần để trung hòa hết lượng axit dư trong B.
Hướng dẫn:
a) Đối với bài tập có hỗn hợp axit, bazo giải theo phương trình ôn
nHCl = 0,25 (mol) ; ![]() \(n_{H_2SO_4}\) = 0,125 (mol);
\(n_{H_2SO_4}\) = 0,125 (mol); ![]() \(n_{H_2}\) = 0,195 (mol)
\(n_{H_2}\) = 0,195 (mol)
= nH+ = 0,25 + 2.0,125 = 0,5 (mol);
![]() \(n_{H_2}\).2 < nH+ ⇒ H+ dư
\(n_{H_2}\).2 < nH+ ⇒ H+ dư
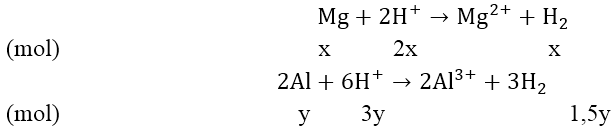
Theo đề bài, ta có hệ phương trình: 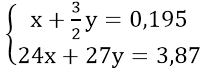
Giải hệ phương trình ta được: x = 0,06 và y = 0,09
⇒ mMg = 1,44 (gam); mAl = 2,43(gam)
b) Gọi thể tích dung dịch C cần dùng là V (lít)
Ta có: nNaOH = 0,02V(mol); ![]() \(n_{Ba(OH)_2}\) = 0,11V (mol)
\(n_{Ba(OH)_2}\) = 0,11V (mol)
⇒ n-OH = 0,2 + 0,2 = 0,4V(mol)
nH+dư = 0,5 - (2x + 3y) = 0,11 (mol)
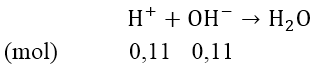
⇒ 0,11 = 0,4V ⇒ V = 0,275 (lít)
B. Bài tập trắc nghiệm kim loại tác dụng với dung dịch axit
Bài 1: Cho 7,8 gam hỗn hợp Mg, Al tác dụng hết với dung dịch HCl dư sau phản ứng thấy khối lượng dung dịch tăng thêm 7 gam. Tính số mol HCl đã tham gia phản ứng.
A. 0,8 mol
B. 0,4mol
C. 0,3 mol
D. 0,25 mol
Đáp án: A
Nhận xét: Kim loại + HCl → muối + H2
Ta có: mdung dịch tăng = mkim loại - mkhí thoát ra
⇒ ![]() \(m_{H_2}\) = 7,8 - 7 = 0,8 (gam) ⇒
\(m_{H_2}\) = 7,8 - 7 = 0,8 (gam) ⇒ ![]() \(n_{H_2}\)= 0,4 (mol)
\(n_{H_2}\)= 0,4 (mol)
Áp dụng bảo toàn nguyên tử H: nHCl = ![]() \(2.n_{_{H_2}}\)= 0,8 (mol).
\(2.n_{_{H_2}}\)= 0,8 (mol).
Bài 2: Cho 10 gam hỗn hợp gồm Al và kim loại M đứng trước hidro trong dãy điện hóa vào 100 ml dung dịch hỗn hợp H2SO4 aM và HCl 3aM thì thu được 5,6 lít khí H2 (đktc), dung dịch X và phần kim loại chưa tan hết có khối lượng 1,7 gam. Cô cạn X thu được m gam muối. xác định giá trị m.
A. 12,4g
B. 28,55g
C. 32,14g
D. 17,46g
Đáp án: B
mmuối = mkim loại phản úng + mgốc axit = 8,3 + 96.0,1 + 35,5.0,3 = 28,55(gam)
Bài 3: Hỗn hợp bột gồm 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần đều nhau. Phần 1 đem đốt cháy hoàn toàn trong oxi dư thu được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 (sản phẩm khử duy nhất). Hãy tính giá trị của V.
A. 14,336l
B. 6,72l
C. 13,36l
D. 4,48l
Đáp án: A
Áp dụng định luật bảo toàn khối lượng đối với phần 1 ta có:
![]() \(m_{O_2}\) = 8,71 - 7,18/2 = 5,12(g) ⇒
\(m_{O_2}\) = 8,71 - 7,18/2 = 5,12(g) ⇒![]() \(n_{O_2}\) = 5,12/32 = 0,16(mol)
\(n_{O_2}\) = 5,12/32 = 0,16(mol)
Do khối lượng kim loại ở hai phần bằng nhau nên số mol do hỗn hợp kim loại nhường là như nhau ⇒ số mol eletron do O2 nhận bằng số mol eletron do N5+ nhận.

⇒ ![]() \(n_{NO_2}\) =
\(n_{NO_2}\) = ![]() \(4n_{O_2}\) = 0,64 ⇒
\(4n_{O_2}\) = 0,64 ⇒ ![]() \(V_{NO_2}\) = 0,64.22,4 = 14,336 (lít)
\(V_{NO_2}\) = 0,64.22,4 = 14,336 (lít)
Bài 4: Cho 3,24 gam một kim loại M tan hết trong 0,1 lít dung dịch HNO3 0,5M. Phản ứng chỉ tạo ra khí NO (trong dung dịch không có sự tạo thành NH4NO3) và nồng độ mol của HNO3 còn lại sau phản ứng giảm đi 5 lần. Xác định tên kim loại M.
A. Al
B. Cu
C. Fe
D. Ag
Đáp án: D
Ta có: ![]() \(n_{HNO_3}\) = 0,5.0,1 = 0,05(mol) ⇒
\(n_{HNO_3}\) = 0,5.0,1 = 0,05(mol) ⇒ ![]() \(n_{HNO_3}\) còn = 0,01(mol)
\(n_{HNO_3}\) còn = 0,01(mol)
⇒ ![]() \(n_{HNO_3}\) phản ứng = 0,04(mol)
\(n_{HNO_3}\) phản ứng = 0,04(mol)
Các quá trình:
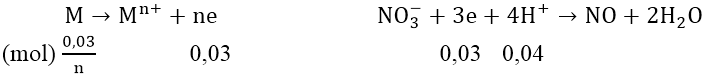
Áp dụng định luật bảo toàn electron ta có:
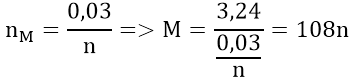
Nghiệm phù hợp: n = 1; M = 108 (Ag)
Bài 5: Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
A. 18,90 gam
B. 37,80 gam
C. 39,80 gam
D. 28,35 gam
Đáp án: C
Ta có: nZn = 13/65 = 0,2 mol và ![]() \(n_{N_2}\) = 0,448/22,4 = 0,02 mol
\(n_{N_2}\) = 0,448/22,4 = 0,02 mol
ne nhường = 2.nZn = 0,4 mol > ne nhận = ![]() \(10.n_{N_2}\) = 0,2 mol → phản ứng tạo thành NH4NO3.
\(10.n_{N_2}\) = 0,2 mol → phản ứng tạo thành NH4NO3.
![]() \(n_{NH_4NO_3}\) = (0,4 - 0,2)/8 = 0,025 mol (vì khi tạo thành NH4NO3: N + 8e → N)
\(n_{NH_4NO_3}\) = (0,4 - 0,2)/8 = 0,025 mol (vì khi tạo thành NH4NO3: N + 8e → N)
Khối lượng muối trong dung dịch X là = 180.0,2 + 80.0,025 = 39,80 gam
Lưu ý: Đề bài không nói thu được khí X duy nhất nên có thể có muối NH4NO3tạo thành.
Bài 6: Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc nóng thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 (dư) vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phần trăm khối lượng của Cu trong hỗn hợp X và giá trị của m lần lượt là:
A. 21,95% và 0,78
B. 78,05% và 0,78
C. 78,05% và 2,25
D. 21,95% và 2,25
Đáp án: B
Ta có: ![]() \(n_{NO_2}\) = 1,344/22,4 = 0,06 mol; gọi nCu = x mol; nAl = y mol
\(n_{NO_2}\) = 1,344/22,4 = 0,06 mol; gọi nCu = x mol; nAl = y mol
Quá trình nhường e:
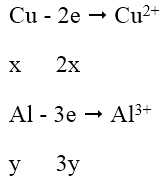
Quá trình nhận e:
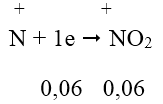
Áp dụng định luật bảo toàn e ta có hệ:
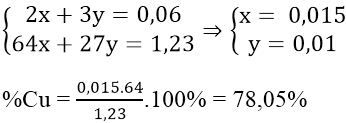
Cu(OH)2 ta được trong dung dịch NH3 dư vì tạo phức, do đó kết tủa thu được là Al(OH)3.
Phản ứng tạo kết tủa:
Bài 7: Hòa tan 4,76 gam hỗn hợp Zn, Al có tỉ lệ mol 1:2 trong 400ml dung dịch HNO3 1M vừa đủ, được dung dịch X chứa m gam muối khan và thấy có khí thoát ra. Giá trị của m là:
A. 25,8 gam
B. 26,9 gam
C. 27,8 gam
D. 28,8 gam
Đáp án: C
Ta có: nZn = 0,04 mol; nAl = 0,08 mol
Do phản ứng không tạo khí nên trong dung dịch tạo NH4NO3. Trong dung dịch có: 0,04 mol Zn(NO3)2 và 0,08 mol Al(NO3)3.
Vậy số mol NO3- còn lại để tạo NH4NO3 là:
0,4 - 0,04.2 - 0,08.3 = 0,08 mol
Do đó trong dung dịch tạo 0,04 mol NH4NO3
m = 0,04.189 + 0,08.213 + 0,04.80 = 27,8 gam
Bài 8: Hòa tan 14,8 gam hỗn hợp gồm Fe và Cu vào lượng dư dung dịch hỗn hợp HNO3 và H2SO4 đặc nóng. Sau phản ứng thu được 10,08 lít NO2 (đktc) và 2,24 lít SO2 (đktc). Khối lượng Fe trong hỗn hợp ban đầu là:
A. 5,6
B. 8,4
C. 18
D. 18,2
Đáp án: B
Gọi a, b lần lượt là số mol của Fe, Cu
56a + 64b = 14,8 (1)
- Quá trình nhường electron:
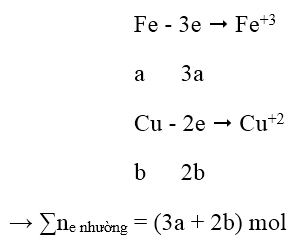
- Quá trình nhận electron:
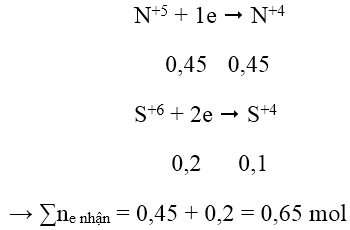
Áp dụng định luật bảo toàn electron:
3a + 2b = 0,65 → a = 0,15 và b = 0,1 → mFe = 8,4 g
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Lý thuyết: Luyện tập tính chất của kim loại
- Lý thuyết: Điều chế kim loại
- Lý thuyết: Luyện tập sự điện phân - Sự ăn mòn kim loại - Điều chế kim loại
- Tính chất chung của kim loại
- Chuỗi phản ứng hóa học của kim loại
- Các dạng bài tập về dãy điện hóa kim loại và pin điện hóa
- Phương pháp giải các bài toán về kim loại
Trên đây VnDoc đã giới thiệu tới các bạn Kim loại tác dụng với dung dịch axit. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải. Mời các bạn cùng tham khảo thêm các môn Toán 12, Ngữ văn 12, tiếng Anh 12, đề thi học kì 1 lớp 12, đề thi học kì 2 lớp 12...
Mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 12 để có thêm tài liệu học tập nhé
Mời các bạn cùng tham khảo thêm các tài liệu:
- Trắc nghiệm Hóa học 12 bài 25: Kim loại kiềm, kim loại kiềm thổ, nhôm
- 165 câu hỏi trắc nghiệm lý thuyết phần Kim loại








