Phương pháp quy đổi trong hóa học vô cơ
VnDoc xin giới thiệu tới bạn đọc Phương pháp quy đổi trong hóa học vô cơ. Nội dung tài liệu sẽ giúp các bạn giải bài tập Hóa học lớp 12 nhanh và chính xác hơn. Mời các bạn tham khảo.
Hóa học 12: Phương pháp quy đổi trong hóa học vô cơ
1. Phương pháp và ví dụ quy đổi trong hóa học vô cơ
Lý thuyết và Phương pháp giải
- Khi quy đổi hỗn hợp nhiều chất (hỗn hợp X) (từ ba chất trở lên) thành hỗn hợp hai chất hay chỉ còn một chất ta phải bảo toàn số mol nguyên tố và bảo toàn khối lượng hỗn hợp.
- Có thể quy đổi hỗn hợp X về bất kì cặp chất nào, thậm chí quy đổi về một chất. Tuy nhiên ta nên chọn cặp chất nào đơn giản có ít phản ứng oxi hóa khử nhất để đơn giản việc tính toán.
- Trong quá trình tính toán theo phương pháp quy đổi đôi khi ta gặp số âm đó là sự bù trừ khối lượng của các chất trong hỗn hợp. Trong trường hợp này ta vẫn tính toán bình phương và kết quả cuối cùng vẫn thỏa mãn.
Khi quy đổi hỗn hợp X về một chất là FexOy thì oxit FexOy tìm được chỉ là oxit giả định không có thực.
Ví dụ minh họa
Bài 1: Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn dung dịch Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
A. 9,75
B. 8,75
C. 7,80
D. 6,50
Hướng dẫn:
Xem Fe3O4 là FeO.Fe2O3
Ta có:
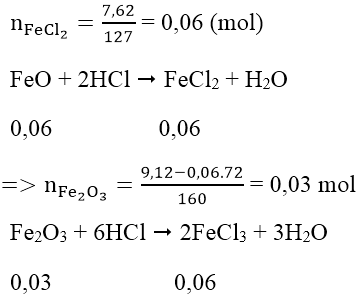
mFeCl3 = 0,06.162,5 = 9,75 (g)
Bài 2: Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
A. 11,2 gam
B. 10,2 gam
C. 7,2 gam
D. 6,9 gam
Hướng dẫn:
Cách 1: Quy hỗn hợp X về 2 chất Fe và Fe2O3:
Hòa tan hỗn hợp X vào dung dịch HNO3 dư ta có:
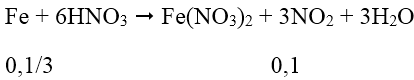
⇒ Số mol nguyên tử Fe trong oxit Fe2O3 là
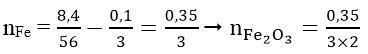
Vậy mX = mFe + mFe2O3
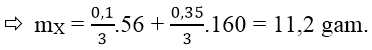
Cách 2: Quy hỗn hợp X về hai chất FeO và Fe2O3:
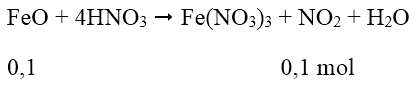
Ta có: 0,15 mol
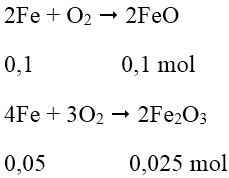
mhh X = 0,1.72 + 0,025.160 = 11,2 gam
Chú ý: Vẫn có thể quy hỗn hợp X về hai chất (FeO và Fe3O4) hoặc (Fe và FeO), hoặc (Fe và Fe3O4) nhưng việc giải trở nên phức tạp hơn (cụ thể là ta phải đặt ẩn số mol mỗi chất, lập hệ phương trình, giải hệ phương trình hai ẩn số).
Cách 3: Quy hỗn hợp X về một chất là FexOy
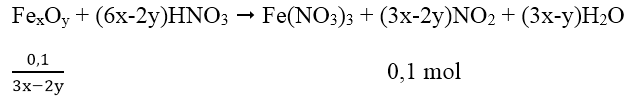
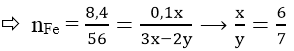
Vậy công thức quy đổi là Fe6O7 (M = 448) và
nFe6O7 = 0,1/(3.6 - 2.7) = 0,025 mol
mX = 0,025.448 = 11,2 gam
Nhận xét: quy đổi hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4 về hỗn hợp hai chất là FeO và Fe2O3 là đơn giản nhất.
2. Bài tập trắc nghiệm phương pháp quy đổi trong hóa học vô cơ
Bài 1: Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phầm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là:
A. 52,2
B. 48,4
C. 54,0
D. 58,0
Đáp án: D
Ta có: nSO2 = 0,145 mol
Quy đổi 20,88 g oxit sắt FexOy thành 20,88 g Fe và O
Gọi nFe = x mol; nO = y mol
Quá trình nhường electron:
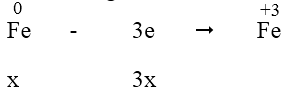
- Quá trình nhận electron:
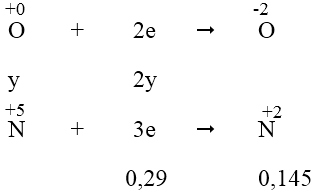
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,29 ⇒ 3x - 2y = 0,29 (1)
Mặt khác: 56x + 16y = 20,88 (2)
Từ (1) và (2) ⇒ x = 0,29 và y = 0,29
Muối sinh ra là muối Fe2(SO4)3. Áp dụng ĐL bảo toàn nguyên tố ta có:
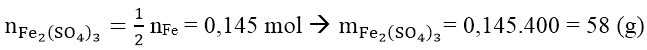
Bài 2: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 38,72
B. 35,50
C. 49,09
D. 34,36
Đáp án: A
Quy đổi hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 thành Fe và Fe2O3.
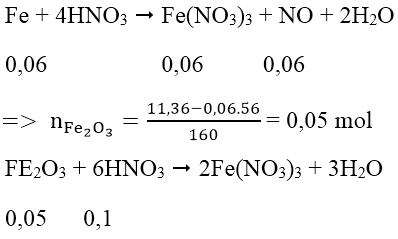
Vậy muối = (0,1 + 0,06).242 = 38,72 (g)
* Cách 2:
Xem hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 chỉ gồm 2 nguyên tố Fe và O
Ta có sơ đồ: Fe: x mol; Fe(NO3)3: x mol
O: y mol
Ta có 56x + 16y = 11,36 (1)
- Quá trình nhường electron:
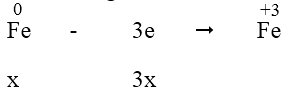
- Quá trình nhận electron:

Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) ⇒ x = 0,16 mol và y = 0,15 mol
mFe(NO3)3 = 0,16.242 = 38,72 (g)
Bài 3: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Tính m?
A. 42,18g
B. 38,72g
C. 36,27g
D. 41,24g
Đáp án: B
Số mol NO = 0,06 mol.
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Gọi số mol Fe và O tương ứng trong X là x và y ta có:
56x + 16y = 11,36 (1).
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
N+5 + 3e → N+2
Áp dụng định luật bảo toàn electron ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) ⇒ x = 0,16 và y = 0,15
⇒ m = 38,72 gam.
Bài 4: Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3). Hòa tan 4,64 gam A trong dung dịch H2SO4 loãng dư được 200 ml dung dịch X. Tính thể tích dung dịch KMnO4 0,1M cần thiết để chuẩn độ hết 100 ml dung dịch X?
A. 0,1l
B. 0,12l
C. 0,2l
D. 0,24l
Đáp án:C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có
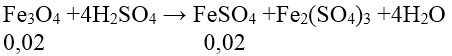
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 lit
Bài 5: Để khử hoàn toàn 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3, cần 0,05 mol H2. Mặt khác hòa tan hoàn toàn 3,04 gam hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được thể tích V ml SO2 (đktc). Giá trị V(ml) là:
A. 112ml
B. 224 ml
C. 336 ml
D. 448 ml.
Đáp án: B
Quy đổi hỗn hợp X về hỗn hợp hai chất FeO và Fe2O3 với số mol là x, y
Ta có:

Có: x + 3y = 0,05 và 72x + 160y = 3,04
⇒ x = 0,02mol; y = 0,01mol
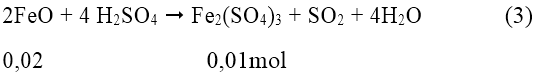
Vậy VSO2 = 0,01 . 22,4 = 0,224 lít hay 224ml
Bài 6: Nung nóng 12,6 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 4,2 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
A. 15g
B. 9g
C. 18g
D. 24g
Đáp án: A
Ta có, nFe = 0,225 mol và nSO2 = 0,1875 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
0,675 = 2x + 0,375 → x = 0,15
Mặt khác ta có: nên: m = 12,6 + 0,15.16 = 15 (gam).
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Lý thuyết Sắt: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Lý thuyết: Hợp kim của sắt
- Lý thuyết Đồng và hợp chất của đồng: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Chuỗi phản ứng hóa học của sắt, crom
- Nhận biết, điều chế sắt và hợp chất của sắt
- Sắt tác dụng với axit HNO3 và H2SO4 đặc nóng
- Kim loại tác dụng với axit, muối
- Xác định tên kim loại và oxit kim loại
Trên đây VnDoc đã giới thiệu tới các bạn Phương pháp quy đổi trong hóa học vô cơ. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








