Lý thuyết Amin: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng
Chuyên đề Hóa học 12 Lý thuyết Amin: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng. Nội dung tài liệu các bạn sẽ giải nhanh bài tập Hóa học 12 chính xác hơn. Mời các bạn tham khảo.
Lý thuyết Amin
I. Khái niệm, phân loại Amin
1. Khái niệm
- Khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon ta được amin.
Ví dụ:
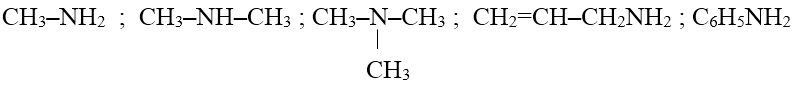
2. Phân loại
a. Theo gốc hiđrocacbon:
– Amin không thơm: CH3NH2, C2H5NH2, ...
– Amin thơm: C6H5NH2, CH3C6H4NH2, ...
– Amin dị vòng: ![]() …
…
b. Theo bậc amin: là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hiđrocacbon. Theo đó, các amin được phân loại thành:
| Amin bậc I | Amin bậc II | Amin bậc III |
|---|---|---|
| R–NH2 | R–NH–R’ | 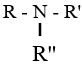 |
| R, R’ và R’’ là gốc hiđrocacbon | ||
Ví dụ:
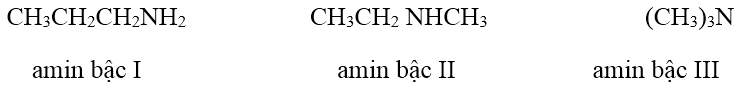
II. Đồng phân, danh pháp của Amin
1. Đồng phân
- Đồng phân về mạch cacbon.
- Đồng phân vị trí nhóm chức.
- Đồng phân về bậc của amin.
Ví dụ: Các đồng phân của C4H11N.
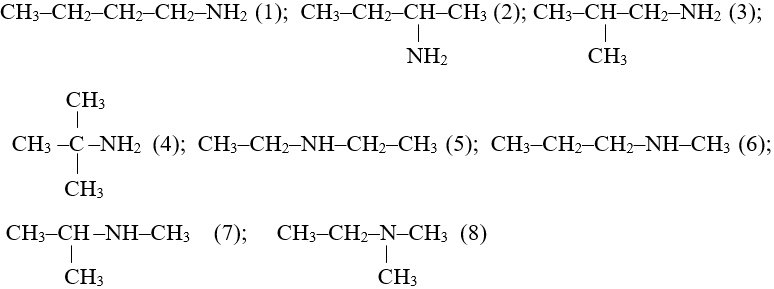
2. Danh pháp
a. Cách gọi tên theo danh pháp gốc - chức: Tên gốc hiđrocacbon + amin
Ví dụ: CH3NH2 (Metylamin), C2H5–NH2 (Etylamin), CH3CH(NH2)CH3 (Isopropylamin), …
b. Cách gọi tên theo danh pháp thay thế: Tên hiđrocacbon + vị trí + amin
Ví dụ: CH3NH2 (Metanamin), C2H5–NH2 (Etanamin), CH3CH(NH2)CH3 (Propan - 2 - amin), ...
c. Tên thông thường chỉ áp dụng với một số amin:
Tên gọi của một số amin
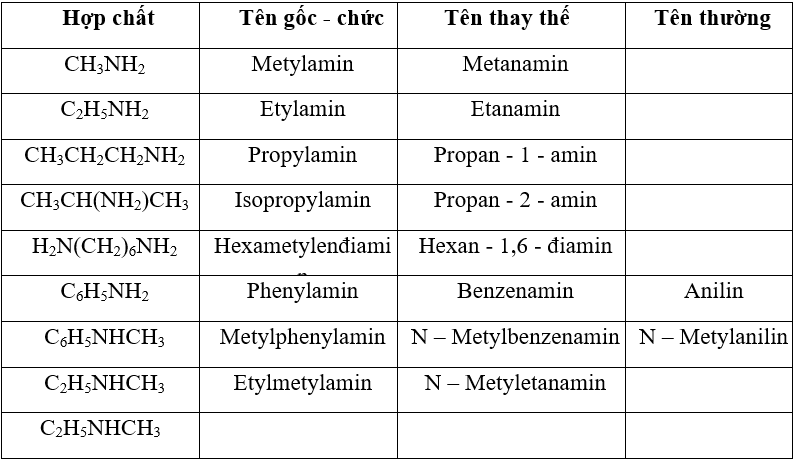
- Lưu ý:
- Tên các nhóm ankyl đọc theo thứ tự chữ cái a, b, c, … + amin.
- Với các amin bậc 2 và 3, chọn mạch dài nhất chứa N làm mạch chính:
+ Có 2 nhóm ankyl → thêm 1 chữ N ở đầu.
Ví dụ: CH3–NH–C2H5: N–etyl metyl amin.
+ Có 3 nhóm ankyl → thêm 2 chữ N ở đầu (nếu trong 3 nhóm thế có 2 nhóm giống nhau).
Ví dụ: CH3–N(CH3)–C2H5: N, N–etyl đimetyl amin.
+ Có 3 nhóm ankyl khác nhau → 2 chữ N cách nhau 1 tên ankyl.
Ví dụ: CH3–N(C2H5)–C3H7: N–etyl–N–metyl propyl amin.
– Khi nhóm –NH2 đóng vai trò nhóm thế thì gọi là nhóm amino.
Ví dụ: CH3CH(NH2)COOH (axit 2–aminopropanoic).
III. Tính chất vật lý của Amin
- Chất rắn, dạng tinh thể, không màu, vị hơi ngọt.
- Nhiệt độ nóng chảy cao, dễ tan trong nước vì amino axit tồn tại ở dạng ion lưỡng cực:
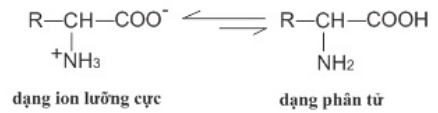
– Metyl–, đimetyl–, trimetyl– và etylamin là những chất khí có mùi khai khó chịu, độc, dễ tan trong nước, các amin đồng đẳng cao hơn là chất lỏng hoặc rắn.
- Anilin là chất lỏng, nhiệt độ sôi là 184oC, không màu, rất độc, ít tan trong nước, tan trong ancol và benzen.
IV. Cấu tạo phân tử và tính chất hóa học của Amin
1. Cấu tạo phân tử
- Trong phân tử amin đều có nguyên tử nitơ còn một cặp electron tự do chưa liên kết có thể tạo cho – nhận giống NH3.
⇒ Vì vậy các amin có tính bazơ giống NH3 (tức tính bazơ của amin = tính bazơ của NH3).
![]()
2. Tính chất hoá học
a. Tính bazơ
Do nguyên tử N trong phân tử amin còn cặp e chưa sử dụng có khả năng nhận proton.
* So sánh tính bazơ của các amin:
+ Nếu nguyên tử N trong phân tử amin được gắn với gốc đẩy e (gốc no: ankyl) thì tính bazơ của amin mạnh hơn so với tính bazơ của NH3. Những amin này làm cho quỳ tím chuyển thành màu xanh.
+ Nếu nguyên tử N trong phân tử amin gắn với các gốc hút e (gốc không no, gốc thơm) thì tính bazơ của amin yếu hơn so với tính bazơ của NH3. Những amin này không làm xanh quỳ tím.
+ Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
⇒ Lực bazơ: CnH2n + 1–NH2 > H–NH2 > C6H5–NH2
- Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein.
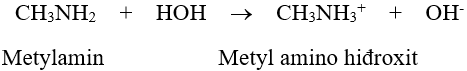
– Amin bậc III mà gốc hiđrocacbon R, R’ và R’’ có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận proton H+ ⇒ tính bazơ yếu ⇒ dung dịch không làm đổi màu quỳ tím và phenolphtalein.
- Anilin và các amin thơm rất ít tan trong nước. Dung dịch của chúng không làm đổ màu quỳ tím và phenolphtalein.
- Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
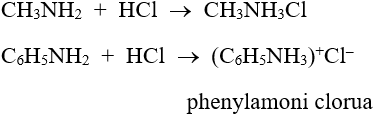
- Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa:
Ví dụ: 3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
- Lưu ý: Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) → hiđroxit kết tủa → kết tủa tan (tạo phức chất).
b. Phản ứng với axit nitrơ HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni:
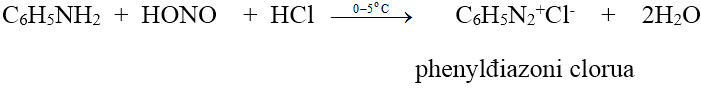
c. Phản ứng ankyl hóa
Amin bậc một hoặc bậc hai tác dụng với ankyl halogenua (CH3I, …), nguyên tử H của nhóm amin có thể bị thay thế bởi gốc ankyl:
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
– Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
d. Phản ứng thế ở nhân thơm của anilin
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom:
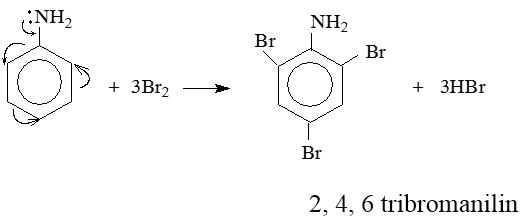
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromanilin dùng nhận biết anilin.
e) Phản ứng cháy của amin no đơn chức mạch hở:
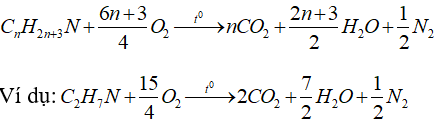
V. Ứng dụng và điều chế của Amin
1. Ứng dụng
Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm (phẩm azo, đen anilin,...), polime (nhựa anilin - fomanđehit,...), dược phẩm (streptoxit, suafaguaniđin,...)
2. Điều chế
- Thay thế nguyên tử H của phân tử amoniac
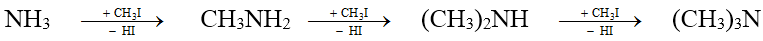
- Khử hợp chất nitro
![]()
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Phản ứng thủy phân Tinh bột, Xenlulozơ
- Xác định công thức phân tử Cacbohidrat
- 100 câu trắc nghiệm Cacbohiđrat có lời giải chi tiết (Cơ bản - phần 1)
- 100 câu trắc nghiệm Cacbohiđrat có lời giải chi tiết (Cơ bản - phần 2)
- 100 câu trắc nghiệm Cacbohiđrat có lời giải chi tiết (Cơ bản - phần 3)
- 100 câu trắc nghiệm Cacbohiđrat có lời giải chi tiết (Nâng cao - phần 1)
- 100 câu trắc nghiệm Cacbohiđrat có lời giải chi tiết (Nâng cao - phần 2)
- 100 câu trắc nghiệm Cacbohiđrat có lời giải chi tiết (Nâng cao - phần 3)
Trên đây VnDoc đã giới thiệu tới các bạn Lý thuyết Amin: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








