Tìm công thức phân tử của Ester dựa vào phản ứng đốt cháy
VnDoc xin giới thiệu tới bạn đọc Tìm công thức phân tử của Este dựa vào phản ứng đốt cháy. Nội dung tài liệu hướng dẫn bạn đọc giải các dạng bài tập liên quan đến phản ứng giải bài tập đốt cháy este, từ đó luyện tập vận dụng làm bài tập. Chắc chắn sẽ giúp các bạn giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Hóa học 12 Tìm công thức phân tử của Este dựa vào phản ứng đốt cháy
I. Phương pháp giải bài tập đốt cháy este
1. Phản ứng đốt cháy 1 este
a. Este no, đơn chức, mạch hở
CTTQ: CnH2nO2, n ≥ 2
- Phản ứng cháy:
CnH2nO2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) nCO2 + nH2O
\(\overset{t^{\circ } }{\rightarrow}\) nCO2 + nH2O
⇒ nCO2 = nH2O
b. Este không no, đơn chức, mạch hở có 1 liên kết C=C:
CTTQ: CnH2n-2O2, n ≥ 4
- Phản ứng cháy:
CnH2n-2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) nCO2+ (n-1)H2O
\(\overset{t^{\circ } }{\rightarrow}\) nCO2+ (n-1)H2O
+ nCO2 > nH2O
+ neste = nCO2 – nH2O
c. Este 2 chức, no, mạch hở
CnH2n-2O4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) nCO2 + (n-1)H2O
\(\overset{t^{\circ } }{\rightarrow}\) nCO2 + (n-1)H2O
+ nCO2 > nH2O
+ neste = nCO2 – nH2O
d. Este không no, đơn chức, có k liên kết C=C trong phân tử
CTTQ: CnH2n-2kO2:
e. Este không no, có từ 2 liên kết C=C trở lên trong phân tử
CnH2n+2-2kOm + O2 → nCO2 + (n+1-k)H2O
nCO2 > nH2O
neste = (nCO2- nH2O)/(k-1)
f. Este bất kì
CTTQ: CxHyOz. x, y, z nguyên dương, x ≥ 2, z ≥ 2
Phản ứng cháy:
CxHyOz + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) xCO2 + y/2 H2O
\(\overset{t^{\circ } }{\rightarrow}\) xCO2 + y/2 H2O
Áp dụng các định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố… để giải bài toán.
2. Bài toán đốt cháy hỗn hợp các este
a. Bài toán đốt cháy 2 este đồng phân
Các este đồng phân ⇒ có cùng CTPT, cùng KLPT.
b. Bài toán đốt cháy 2 este tạo thành từ cùng 1 axit, 2 ancol đồng đẳng hoặc cùng 1 ancol, 2 axit đồng đẳng:
Các este này sẽ có cùng dạng CTTQ ⇒ Đặt CTPT trung bình để viết phương trình phản ứng, đưa về bài toán 1 este.
số liên kết pi trong phân tử: ![]()
c. Bài toán đốt cháy hỗn hợp nhiều este có cùng CTTQ
Đặt CTPT trung bình
Áp dụng các định luật bảo toàn để giải bài toán.
II. Bài tập ví dụ minh họa đốt cháy este
Ví dụ 1: Đốt cháy 6 gam este Y ta thu được 4,48 (l) CO2 (đktc) và 3,6 (g) H2O. Tìm CTCT của Y.
Đáp án hướng dẫn giải
nCO2 = 0,2 mol ; nH2O = 0,2 mol
Ta có: nCO2 = nH2O ⇒ este Y no, đơn chức, mạch hở
Đặt CTTQ của Y là CnH2nO2
CnH2nO2 + O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) nCO2 + nH2O
\(\overset{t^{\circ } }{\rightarrow}\) nCO2 + nH2O
14n + 32 n
6 0,2
⇒ (14n +32).0,2 = 6n ⇒ n = 2
⇒ CTPT của Y: C2H4O2
⇒ CTCT của Y: HCOOCH3
Ví dụ 2: X là một este đơn chức, có tỷ khối hơi đối với CH4 là 5,5. Nếu đem đun 2,2 gam este X với dung dịch NaOH dư thu được 2,05 g muối. Xác định CTCT của X.
Đáp án hướng dẫn giải
MX = 5,5 . 16 = 88 ⇒ X: C4H8O2
Do X là este no đơn chức nên nmuối = nX = 2,2/88 = 0,025 (mol)
Mmuối = 2,05/0,025 = 82 ⇒ muối CH3COONa
⇒ Công thức cấu tạo thu gọn của X là: CH3COOC2H5
Ví dụ 3: Đốt cháy hoàn toàn hỗn hợp X gồm 2 este no đơn chức kế tiếp nhau trong dãy đồng đẳng thu được 2,7gam nước và V lít CO2 (đkc). Giá trị của V là?
Đáp án hướng dẫn giải
2 este no, đơn chức đồng đẳng có công thức tổng quát: CmH2mO2 (chọn hỗn hợp là 1 mol)
CmH2mO2 → mCO2 + mH2O
1 m m (mol)
Ta thấy: nCO2 = nH2O = 2,7/18 = 0,15(mol)
VCO2 = 0,15.22,4 = 3,36(lit)
Ví dụ 4. Cho 0,3 mol hỗn hợp X gồm hai este đơn chức tác dụng vừa đủ với 250 ml dung dịch KOH 2M, thu được chất hữu cơ Y (no, đơn chức, mạch hở, có tham gia phản ứng tráng bạc) và 53 gam hỗn hợp muối. Đốt cháy toàn bộ Y cần vừa đủ 5,6 lít O2 (đktc). Khối lượng của 0,3 mol X là
A. 31,0 gam.
B. 41,0 gam.
C. 33,0 gam.
D. 29,4 gam.
Đáp án hướng dẫn giải bài tập
Đáp án C
nKOH = 0,5 mol; neste = 0,3 mol
=> 1 < nKOH : neste = 0,5 : 0,3 = 1,67 < 2 => X chứa 1 este của phenol
Đặt x, y lần lượt là số mol của este thường và este của phenol
nX = x + y = 0,3
nKOH = x + 2y = 0,5
Giải hệ được x = 0,1 và y = 0,2
Y có phản ứng tráng bạc nên Y là anđehit.
nY = x = 0,1 mol;
* Xét phản ứng đốt Y:
Đặt công thức của Y là CnH2nO
CnH2nO + (3n-1)/2 O2 → nCO2 + nH2O
0,1 mol → 0,25 mol
=> 0,1.(3n - 1)/2 = 0,25 => n = 2 (CH3CHO)
*Xét phản ứng thủy phân X: nH2O = y = 0,2 mol
Bảo toàn khối lượng: mX = mmuối + mY + mH2O – mKOH = 53 + 0,1.44 + 0,2.18 – 0,5.56 = 33 gam
Ví dụ 5. Đốt cháy hoàn toàn este no, đơn chức, mạch hở X thấy thể tích khí O2 cần dùng gấp 1,25 lần thể tích CO2 tạo ra. Số lượng công thức cấu tạo của X.
Đáp án hướng dẫn giải bài tập
Gọi công thức của este no, đơn chức, mạch hở là: CnH2nO2: 1 mol
CnH2nO2 + (3n-2)/2O2 → nCO2 + nH2O
1→ 0,5(3n - 2 ) → n (mol)
Ta có:
VO2/VCO2 =1,25 ⇒ 0,5(3n−2)/n = 1,25 ⇒ 1,5n−1 = 1,25/n ⇒ n = 4
=> Công thức phân tử của este là: C4H8O2
Có 4 công thức cấu tạo thỏa mãn là: HCOOCH2CH2CH3; HCOOCH(CH3)CH3; CH3COOC2H5; C2H5COOCH3
Ví dụ 6: Đốt cháy hoàn toàn 7,4 gam hỗn hợp hai este đồng phân, thu được 6,72 lít CO2 ( ở đktc) và 5,4 gam H2O. Xác định công thức cấu tạo của 2 este đó.
Đáp án hướng dẫn giải bài tập
nCO2 = 0,3 mol
nH2O = 0,3 mol
=> nH2O = nCO2
=> Các este đều là este no, đơn chức mạch hở: CnH2nO2
Bảo toàn kim loại
meste + mO2= mCO2 + mH2O
⇔ 7,4 + mO2 = 0,3.44 + 0,3.18
⇔mO2 = 11,2g=> nO2 = 0,35 mol
Bảo toàn nguyên tố oxi oxi:
2neste + 2nO2 = 2nCO2 + nH2O
⇔2neste + 0,35.2 = 2.0,3 + 0,3
⇔ neste = 0,1 mol
2neste + 2nO2 = 2nCO2 + nH2O
⇔ 2neste + 0,35.2 = 2.0,3 + 0,3 ⇔ neste= 0,1 mol
=> Meste =7,4/0,1 = 74
=> Công thức phân tử: C3H6O2
III. Bài tập vận dụng tìm công thức phân tử este
Câu 1. Đốt cháy hoàn toàn 7,8 gam este X thu được 11,44 gam CO2 và 4,68 gam H2O. Công thức phân tử của este là
A. C4H8O4
B. C4H8O2
C. C2H4O2
D. C3H6O2
nCO2 = nH2O = 0,26 mol
⇒ este là no, đơn chức
Gọi công thức este là CnH2nO2
⇒ 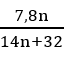 = nCO2 = 0,26 ⇒ n = 2 ⇒ CTPT: C2H4O2
= nCO2 = 0,26 ⇒ n = 2 ⇒ CTPT: C2H4O2
Đáp án C
Câu 2. X là một este tạo từ axit và ancol no. Đốt cháy hoàn toàn 1 mol X thu được 3 mol CO2. Hãy cho biết có bao nhiêu este thoả mãn?
A. 1
B. 2
C. 3
D. 4
nCO2 = 3nX ⇒ X có 3 nguyên tử C
X no nên chỉ có thể là: HCOOCH2CH3 ; CH3COOCH3
Câu 3. Thực hiện phản ứng este hoá giữa axit axetic với 2 ancol no đơn chức là đồng đẳng kế tiếp nhau thu được hỗn hợp 2 este. Đốt cháy hoàn toàn 0,1 mol hỗn hợp 2 este đó thu được 10,08 lít CO2. Hãy lựa chọn công thức cấu tạo của 2 ancol?
A. CH3OH và C2H5OH
B. C2H5OH và CH3CH(OH)CH3
C. C2H5OH và CH3CH2CH2OH
D. n-C3H7OH và n-C4H9OH
Số C trung bình trong este: nCO2/ neste = 4,5
⇒ số C trung bình của 2 ancol là 4,5 – 2 = 2,5.
⇒ 2 ancol là C2H5OH và C3H7OH
Câu 4. Đốt cháy hoàn toàn 1,32 gam một este X thu được 1,344 lít CO2 (ở đktc) và 1,08 gam nước. Khi đun nóng m gam X với dung dịch NaOH dư đến phản ứng hoàn toàn thu được 41m/44 gam muối. Công thức cấu tạo của X là
A. CH3COO-CH3
B. H-COO-CH2C2H5
C. CH3COO-C2H5
D. C2H5COO-CH3
nCO2 = nH2O = 0,06mol → nC = 0,06mol
nH = 0,12 mol và nO = (mX - mC - mH)/16 = 0,03 mol
→ C : H : O = 2 : 4 : 1
X no, đơn chức nên X là C4H8O2
mRCOONa = mRCOONa = 41.mX/44 gam
Vì nRCOONa = nX nên: R + 67 = 41.88/44
→ R = 15: -CH3 ⇒ X là CH3COOC2H5
Câu 5. Khi đốt cháy hoàn toàn một este no, đơn chức thì số mol CO2 sinh ra bằng số mol O2 đã phản ứng. Tên gọi của este là:
A. n-propyl axetat.
B. metyl axetat.
C. etyl axetat.
D. metyl fomat.
Este no, đơn chức: CnH2nO2 (n ≥ 2) (chọn 1 mol)
CnH2nO2 + (3n- 2)/2 O2 → nCO2 + nH2O
1 mol (3n-2)/2 n
nCO2 = nO2 => n = (3n - 2)/2 => n = 2 => C2H4O
⇒ CT este: HCOOCH3: metyl fomat
Câu 6. Đốt cháy 3g một este Y ta thu được 2,24 lít khí (ĐKTC) và 1,8g H2O. Y có CTCT thu gọn là?
A. HCOOCH3
B. CH3COOCH3
C. HCOOC2H5
D. CH3COOC2H5
nCO2 = 0,1mol, nH2O = 0,1mol
nCO2 = nH2O ⇒ este no, đơn chức.
CnH2nO2 + (3n - 2)/2 O2 → nCO2 + nH2O
14n + 32 (gam) n
3 gam 0,1
(14n + 32)/3 = n/0,1 => n = 2. CTPT C2H4O2
Câu 7. Đốt cháy hoàn toàn 1,1g một hợp chất hữu cơ X thu được 2,2g CO2 và 0,9g H2O. Cho 4,4g X tác dụng vừa đủ với 50ml dd NaOH 1M thì tạo ra 4,8g muối. CTCT của X là:
A. C2H5COOCH3
B. CH3COOC2H5
C. HCOOCH2CH2CH3
D. HCOOC3H7
nCO2 = 0,05 mol, nH2O= 0,05 mol
nCO2 = nH2O. Vậy este no, đơn chức.
CnH2nO2 + (3n - 2)/2 O2 → nCO2 + nH2O
14n + 32 (gam) n
(14n + 32)/1,1 = n/0,05 =>n = 4. CTPT C4H8O2
RCOOR′ + NaOH → RCOONa + R′OH
nX = nNaOH = 0,05 mol
Mmuối = 4,8/0,05 = 96
Vậy muối là C2H5COONa
Vậy este là C2H5COOCH3
Câu 8. Đốt cháy este 2 chức mạch hở (X được tạo từ axit cacboxylic no, đa chức, phân tử X không có quá 5 liên kết pi) thu được tổng thể tích CO2 và H2O gấp 5/3 lần thể tích O2 cần dùng. Lấy 21,6 gam X tác dụng hoàn toàn với 400ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị lớn nhất của m là?
A. 28,0
B. 26,2
C. 24,8
D. 24,1
→ 8x – y = 40
→ x = 6 & y = 8
→ X là C6H8O4
X tạo từ axit no nên X là:
CH3-OOC-CH2-COO-CH=CH2 (0,15 mol)
→ Chất rắn gồm CH2(COONa)2 (0,15mol) và NaOH dư (0,1mol)
→ mrắn = 26,2g
...................................









