Chuyên đề bài tập Nguyên tố nhóm IA
Đây là tài liệu Cao cấp - Chỉ dành cho Thành viên VnDoc ProPlus.
- Tải tất cả tài liệu lớp 12 (Trừ Giáo án, bài giảng)
- Trắc nghiệm không giới hạn
Kim loại nhóm IA
Chuyên đề bài tập Hóa 12 Kim loại nhóm IA Có đáp án do VnDoc biên soạn, tổng hợp nhằm giúp các em ôn tập và rèn luyện các kĩ năng làm các dạng câu hỏi bài tập liên quan đến nội dung Hóa 12 Chương 7 Kim loại nhóm IA. Tài liệu áp dụng cho cả 3 sách giáo khoa, Kết nối tri thức và cuộc sống, Chân trời sáng tạo và Cánh diều.
Giới thiệu về tài liệu
Chuyên đề bài tập Hóa 12 Kim loại nhóm IA Có đáp án gồm 2 phần.
Phần A. Nhắc lại nội dung kiến thức đã học về kim loại nhóm IA
Phần B. Các câu hỏi với môn thi trắc nghiệm được chia thành 3 phần, trong đó
- Phần 1: gồm các câu hỏi ở dạng trắc nghiệm nhiều lựa chọn, cho 4 phương án chọn 1 đáp án đúng.
- Phần 2: gồm các câu hỏi ở dạng trắc nghiệm dạng Đúng/Sai.
- Phần 3: gồm các câu hỏi ở dạng trả lời ngắn.
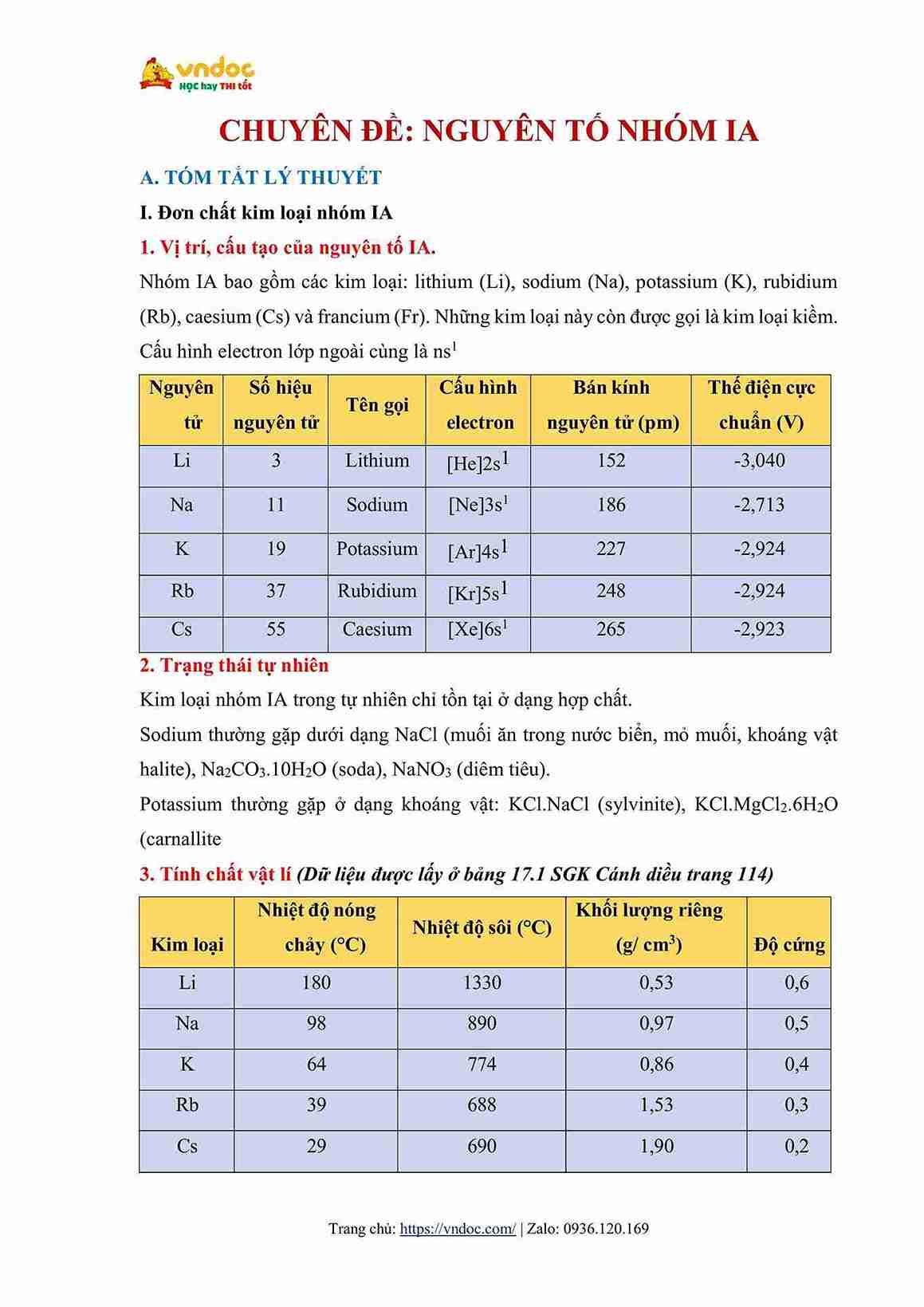
Hình ảnh minh họa về tài liệu Chuyên đề bài tập Hóa 12 Kim loại nhóm IA Có đáp án







>> Tiếp theo: Chuyên đề bài tập Hóa 12 Kim loại nhóm IIA Có đáp án










