Orbital nguyên tử là gì? Số Orbital nguyên tử trong một phân lớp, một lớp?
Orbital nguyên tử
I. Obitan nguyên tử là gì?
Orbital nguyên tử (Atomic Orbital, viết tắt AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%).
1. Hình dạng orbital nguyên tử
Khi chuyển động trong nguyên tử, các electron có những mức năng lượng khác nhau đặc trưng cho trạng thái chuyển động của nó.
Dựa trên sự khác nhau về hình dạng, sự định hướng của orbital trong nguyên tử để phân loại orbital thành orbital s, orbital p, orbital d và orbital f.
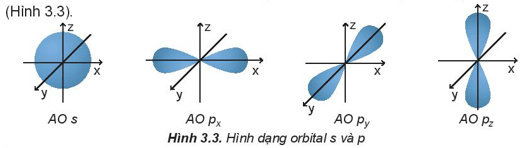
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
2. Ô orbital
Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital.
Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí loại trừ Pau – li).
- Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên.
- Nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
II. Lớp và phân lớp electron
Trong nguyên tử, các electron được sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao.
1. Lớp electron
Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân.
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Người ta đánh số thứ tự lớp từ trong ra ngoài và được biểu thị bằng các số nguyên n = 1, 2, 3, …, 7 với tên gọi là các chữ cái in hoa như sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
2. Phân lớp electron
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường, theo thứ tự: s, p, d, f.
Các electron trên cùng một phân lớp có năng lượng bằng nhau.
Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
- Lớp thứ nhất (lớp K, với n = 1) có một phân lớp, được kí hiệu là 1s.
- Lớp thứ hai (lớp L, với n = 2) có hai phân lớp, được kí hiệu là 2s và 2p.
- Lớp thứ ba (lớp M, với n = 3) có ba phân lớp, được kí hiệu là 3s, 3p và 3d.
- Lớp thứ tư (lớp N, với n = 4) có bốn phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Các electron ở phân lớp s gọi là electron s, các electron ở phân lớp p được gọi là electron p….
III. Số obitan nguyên tử trong một phân lớp, một lớp
Trong một phân lớp, các orbital có cùng mức năng lượng.
- Phân lớp s: có 1 AO s
![]()
- Phân lớp p: có 3 AO px, py, pz
![]()
- Phân lớp d: có 5 AO
![]()
- Phân lớp f: có 7 AO
![]()
Trong lớp electron thứ n có n2 AO (n ≤ 4).
Ví dụ: Lớp L (n = 2) có 2 phân lớp là 2s và 2p. Trong đó, phân lớp 2s có 1AO, phân lớp 2p có 3AO nên tổng số orbital trong lớp L là 1 + 3 = 4 hay 22 AO.
--------------------------------------
- Công thức tính phân tử khối
- Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
- Đồng vị là gì?
- Cách điều chế Iot
- Tính kim loại là gì? Tính phi kim là gì? Nêu sự biến đổi
- Những chất làm mất màu dung dịch Brom?
- Hoàn thành PTHH sau: Mg + HNO3?
- Nguyên tố hoá học là những nguyên tử có cùng
- Bài tập phản ứng oxi hóa khử
- Các dạng bài tập hóa 10 từ khó đến nâng cao
- SO2 ra NaHSO3 - Phản ứng SO2 dư NaOH cho sản phẩm gì?
- Kí hiệu nguyên tử là gì? Cách viết kí hiệu nguyên tử?
- Hoàn thành PTHH: SO2 + NaOH
- Phản ứng thuận nghịch là gì?
- Phản ứng Agcl ra Cl2 - Điều chế Cl2 từ AgCl
- V2O5 là gì?
- Trình bày cách pha loãng axit sunfuric đặc an toàn
- Trong phòng thí nghiệm, người ta thường điều chế Clo bằng cách
- Hiện nay, có bao nhiêu nguyên tố kim loại đã được biết?
- Nhóm nguyên tố là gì? Bảng tuần hoàn có bao nhiêu cột?
- Tại sao nói axit H2S có tính khử mạnh?
- NaHSO3 ra SO2 - Điều chế SO2 từ muối natri hidrosunfit
- Phương pháp bảo toàn e trong hóa hữu cơ
- Hoàn thành PTHH: Al + HNO3 → Al(NO3)3 + NO + H2O
- Nêu thành phần và tác dụng của nước clo?
- Nêu số electron tối đa trong một phân lớp s; p; d; f và cách tính số electron
- NH4Cl là chất gì?
- Hợp chất của nguyên tố X với O là X2O3
- Nêu đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A?
- SO2 ra Na2SO3 - Phản ứng SO2 + NaOH dư cho sản phẩm gì?
- Phương trình phản ứng: C2H4 + Br2
- Công thức tính nguyên tử khối trung bình
- Tính chất hóa học cơ bản của halogen
- Nêu cấu hình electron nguyên tử halogen?
- Số khối là gì? Cách xác định số khối của hạt nhân nguyên tử?
- Nêu tính chất hóa học cơ bản của nước Javen
- Cân bằng PTHH sau: SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
- Phương pháp Sunfat được dùng để điều chế
- Cân bằng PTHH sau: NaOH +KHCO3 → Na2CO3 + K2CO3 + H2O
- Tính chất hóa học của H2S
- Phương trình phản ứng Al(OH)3 + NaOH
- Nguyên tố hóa học bao gồm các nguyên tử
- Trình bày phương pháp phân biệt các ion halogenua
- Đặc điểm cấu tạo của Metan
- Tính chất hóa học của Axit clohidric
- Photpholipit có chức năng chủ yếu là
- Phân biệt 3 kim loại Al, Fe, Cu
- Nhiệt độ sôi của Axit Axetic
- Sự chuyển dịch cân bằng hóa học và các yếu tố ảnh hưởng
- Viết các phương trình hóa học chứng minh Clo vừa có tính oxi hóa
- Nêu tính chất hóa học cơ bản của các halogen
- Tính chất vật lý của SO2
- Để điều chế HCl trong công nghiệp, người ta sử dụng phương pháp
- Trình bày các phương pháp sản xuất axit clohiđric
- Điều chế H2S trong phòng thí nghiệm và công nghiệp
- Phương trình phản ứng: Fe + HNO3
- Viết các phương trình hóa học chứng minh tính oxi hóa
- Hiện tượng thăng hoa là gì?
- Công thức cấu tạo của NO2
- Cách xác định số e lớp ngoài cùng
- Tính chất hóa học của SO2
- Nguyên tử khối là gì? Cách xác định nguyên tử khối?
- Hoàn thành PTHH: Fe3O4 + HCl
- Tính háo nước của axit sunfuric đặc
- Bảng tuần hoàn gồm mấy chu kì? Số nguyên tố trong mỗi chu kì
- Viết PTHH khi cho SO3 tác dụng với H2O
- Cách điều chế H2SO4 từ FeS2?
- Nồng độ Ca2+ trong cây là 0,3%, trong đất là 0,1%. Cây sẽ nhận Ca2+ bằng cách nào?
- CH4 là chất gì?
- Hợp chất của nguyên tố R với nhóm Hidroxit có dạng R(OH)3
- Cách tính điện tích hạt nhân
- Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học
- Hoàn thành PTHH sau: FeCO3 + HNO3?
- Công thức chung của oxit kim loại thuộc nhóm 1A là
- Cấu tạo bảng tuần hoàn
- Hoàn thành PTHH sau: Al + HNO3?
- Oleum là gì?
- Nêu thứ tự các mức năng lượng trong nguyên tử
- Bảng tuần hoàn có bao nhiêu nhóm B? Các nhóm B gồm bao nhiêu cột?
- Nhận xét về độ âm điện của các halogen?
- Cho biết sản phẩm tạo thành khi cho Ag tác dụng với H2SO4 loãng
- CH3COOH là chất gì?
- Hợp chất của nguyên tố R với hidro là RH4
- Để phân biệt 2 dung dịch HCl và H2SO4 loãng ta dùng một kim loại là
- Hợp chất đường chiếm thành phần chủ yếu trong mật ong
- Điện tích nguyên tố là gì?
- Điều chế oxi trong phòng thí nghiệm từ KMnO4, KClO3, NaNO3, H2O2 (có số mol bằng nhau), lượng oxi thu được nhiều nhất
- Trình bày cách nhận biết ion clorua
- Phân lớp electron là gì? Thế nào là phân lớp electron bão hòa?
- Tính chất hóa học của axit sunfuric (H2SO4) đặc và loãng
- Cách tính hóa trị cao nhất trong oxit của nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro










