Tóm tắt lý thuyết Hóa học 10 - Chương 4: Phản ứng oxi hóa - khử
Tóm tắt lý thuyết Hóa học 10 - Chương 4: Phản ứng oxi hóa - khử
Tóm tắt lý thuyết Hóa học 10 - Chương 4: Phản ứng oxi hóa - khử giúp các bạn học sinh hệ thống lại kiến thức Hóa vô cơ chương 4 lớp 10, từ đó biết cách xác định loại phản ứng, trên cơ sở đó có thể viết và cân bằng phương trình phản ứng và giải thích hiện tượng thực tế. Mời các bạn cùng tham khảo.
Chương 4: PHẢN ỨNG OXI HOÁ - KHỬ
I. Tóm tắt lý thuyết chương 4: Phản ứng oxi hóa khử
Phản ứng oxi hóa khử là phản ứng trong đó nguyên tử (hay ion) này nhường electron cho nguyên tử (hay ion) kia.
Trong một phản ứng oxi hoá - khử thì quá trình oxi hoá và quá trình khử luôn luôn xảy ra đồng thời.
Điều kiện phản ứng ôxi hóa - khử là chất ôxi hóa mạnh tác dụng với chất khử mạnh để tạo thành chất oxi hóa và chất khử yếu hơn.
1. Chất oxi hóa là chất nhận electron, kết quả là số oxi hóa giảm.
Nếu hợp chất có nguyên tử (hay ion) mang soh cao nhất là chất ôxi hóa (SOH cao nhất ứng với STT nhóm) hay số oix hóa trung gian (sẽ là chất khử nếu gặp chất oxi hóa mạnh).
Ion kim loại có soh cao nhất Fe3+, Cu2+, Ag+...
Anion NO3- trong môi trường axit là chất ôxi hóa mạnh (sản phẩm tạo thành là NO2, NO, N2O, N2, hay NH4); trong môi trường kiềm tạo sản phẩm là NH3 (thường tác dụng với kim loại mà oxit và hiđrôxit là chất lưỡng tính); trong môi trường trung tính thì xem như không là chất oxi hóa.
H2SO4 Đặc là chất oxi hóa mạnh (tạo SO2, S hay H2S)
MnO4- còn gọi là thuốc tím (KMnO4) trong môi trường H+ tạo Mn2+ (không màu hay hồng nhạt), môi trường trung tính tạo MnO2 (kết tủa đen), môi trường OH- tạo MnO42- (xanh).
2. Chất khử là chất nhường electron, kết quả là số oxi hóa tăng.
Nếu hợp chất có nguyên tử (hay ion) mang soh thấp nhất là chất khử (soh thấp nhất ứng với 8 - STT nhóm) hay chứa số oxi hoá trung gian (có thể là chất oxi hóa khi gặp chất khử mạnh)
Đơn chất kim loại, đơn chất phi kim (C, S, P, N...).
Hợp chất (muối, bazơ, axit, oxit) như: FeCl2, CuS2, Fe(OH)3, HBr, H2S, CO, Cu2O...
Ion (cation, anion) như: Fe2+, Cl-, SO32-...
3. Qúa trình oxi hóa là quá trình (sự) nhường electron.
4. Qúa trình khử là quá trình (sự) nhận electron.
5. Số oxi hóa
là điện tích của nguyên tử (điện tích hình thức) trong phân tử nếu giả định rằng các cặp electron chung coi như chuyển hẳn về phía nguyên tử có độ âm điện lớn hơn.
Qui ước 1: Số oxi hoá của nguyên tử dạng đơn chất bằng không
Fe0 Al0 H20 O20 Cl20
Qui ước 2: Trong phân tử hợp chất, số oxi hoá của nguyên tử Kim loại nhóm A là +n; Phi kim nhóm A trong hợp chất với kim loại hoặc hyđro là 8 - n (n là STT nhóm)
Kim loại hoá trị 1 là +1: Ag+1Cl Na2+1SO4 K+1NO3
Kim loại hoá trị 2 là +2: Mg+2Cl2 Ca+2CO3 Fe+2SO4
Kim loại hoá trị 3 là +3: Al+3Cl3 Fe2+3(SO4)3
Của oxi thường là –2: H2O-2 CO2-2 H2SO4-2 KNO3-2
Riêng H2O2-1 F2O+2
Của Hidro thường là +1: H+1Cl H+1NO3 H2+1S
Qui ước 3: Trong một phân tử tổng số oxi hoá của các nguyên tử bằng không.
H2SO4 2(+1) + x + 4(-2) = 0 → x = +6
K2Cr2O7 2(+1) + 2x + 7(-2) = 0 → x = +6
Qui ước 4: Với ion mang điện tích thì tổng số oxi hoá của các nguyên tử bằng điện tích ion. Mg2+ số oxi hoá Mg là +2, MnO4- số oxi hoá Mn là: x + 4(-2) = -1 → x = +7
6. Cân bằng phương trình phản ứng oxi hóa khử
Bước 1. Xác định số oxi hoá các nguyên tố. Tìm ra nguyên tố có số oxi hoá thay đổi.
Bước 2. Viết các quá trình làm thay đổi số oxi hoá
Chất có oxi hoá tăng: Chất khử - ne → số oxi hoá tăng
Chất có số oxi hoá giảm: Chất oxi hoá + me → số oxi hoá giảm
Bước 3. Xác định hệ số cân bằng sao cho số e cho = số e nhận
Bước 4. Đưa hệ số cân bằng vào phương trình, đúng chất và kiểm tra lại theo trật tự: kim loại – phi kim – hidro – oxi
Fe2+3O3-2 + H02 → Fe0 + H2+1O-2
2Fe3+ + 6e →2Fe0 quá trình khử Fe3+
2H0 - 2e → 2H+ quá trình oxi hóa H2
(2Fe3+ + 3H2 → 2Fe0 + 3H2O)
Cân bằng:
Fe2O3 + 3H2 → 2Fe + 3H2O
Chất oxi hoá chất khử
Fe3+ là chất oxi hoá H2 là chất khử
Ví dụ: Cân bằng phản ứng oxi hóa – khử sau:
Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Hướng dẫn cân bằng phương trình oxi hóa khử
Fe3(+8/3) → 3Fe(+3) + 1e
N(+5) + 3e →N(+2)
Fe3O4 là chất bị oxi hóa, HNO3 vừa là môi trường vừa là chất bị khử.
Cứ 28 phân tử HNO3 tham gia phản ứng chỉ có 1 phân tử đóng vai trò là chất bị khử, 27 phân tử còn lại đóng vai trò là môi trường.
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
7. Phân loại phản ứng oxi hóa khử
Môi trường
Môi trường axit: MnO4- + Cl- + H+ → Mn2+ + Cl2 + H2O
Môi trường kiềm: MnO4- + SO32- + OH- → MnO42- + SO42- + H2O
Môi trường trung tính: MnO4- + SO32- + H2O → MnO2 + SO42- + OH-
Chất phản ứng
KClO3 ![]() \(\overset{MnO_{2} }{\rightarrow}\) KCl + 3/2O2
\(\overset{MnO_{2} }{\rightarrow}\) KCl + 3/2O2
Phản ứng oxi hóa - khử nội phân tử: Là phản ứng oxi hóa - khử trong đó chất khử và chất oxi hóa đều thuộc cùng phân tử.
Phản ứng tự oxi hóa - tự khử là phản ứng oxi hóa – khử trong đó chất khử và chất oxi hóa đều thuộc cùng một nguyên tố hóa học, và đều cùng bị biến đổi từ một số oxi hóa ban đầu.
Cl2 + 2 NaOH → NaCl + NaClO + H2O
8. Cân bằng ion electron
Phản ứng trong môi trường axit mạnh (có H+ tham gia phản ứng) thì vế nào thừa Oxi thì thêm H+ để tạo nước ở vế kia.
Phản ứng trong môi trường kiềm mạnh (có OH- tham gia phản ứng) thì vế nào thừa Oxi thì thêm nước để tạo OH- ở vế kia.
Phản ứng trong môi trường trung tính (có H2O tham gia phản ứng) nếu tạo H+, coi như H+ phản ứng; nếu tạo OH- coi như OH- phản ứng nghĩa là tuân theo các nguyên tắc đã nêu trên.
Ví dụ: Xét phản ứng: Al + HNO3 → Al(NO3)3 + N2O + H2O
Hướng dẫn cân bằng phương trình oxi hóa khử
Bước 1: Viết chất khử, chất oxh và những sản phẩm phản ứng (các nửa phản ứng)
Al→ Al+3 (1)
2NO3 → N2O (2)
Bước 2: Ta cân bằng điện tích và khối lượng.
Thêm vào nửa phản ứng (1) 3e để cân bằng điện tích.
Al → Al +3 + 3e
Thêm vào nửa phản ứng (2): Vì 2NO3 khi tạo thành N2O mất đi 5 oxi, 5 oxi này đã chuyển trong nước. Vậy 2 ion NO3 phải cần 10H+ để tạo thành 5H2O
2NO3 + 10H+ → N2O + 5H2O
Để cân bằng điện tích 2 vế ta phải thêm vào nửa phản ứng 8e.
2NO3 + 10H+ + 8e → N2O + 4H2O
Bước 3: Cân bằng electron
8x I Al → Al3+ + 3e
3x I 2NO3 + 10H+ + 8e → N2O + 5H2O
Bước 4: Cộng 2 nửa phản ứng có nhân thêm hệ số cân bằng
8Al + 2NO3 + 30H+ → 8Al3+ + 3N2O + 15H2O
Bước 5: Chuyển phương trình ion thành phương trình phân tử theo các hệ số đã có ở trên.
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
9. Cặp oxi hóa khử là dạng oxi hóa và dạng khử của cùng một nguyên tố. Cu2+/Cu; H+/H2.
10. Dãy điện hóa là dãy những cặp oxi hóa - khử được xếp theo chiều tăng tính oxi hóa và chiều giảm tính khử.
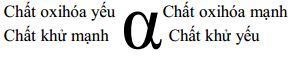
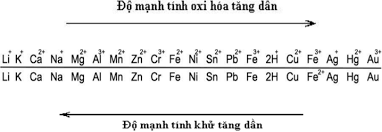
11. Các chú ý để làm bài tập
Khi hoàn thành chuỗi phản ứng tính số oxi hóa để biết đó là phản ứng oxi hóa - khử hay không.
Để chứng minh hoặc giải thích vai trò của một chất trong phản ứng thì trước hết dùng số oxi hóa để xác định vai trò và lựa chất phản ứng.
Toán nhớ áp dụng định luật bảo toàn electron dựa trên định luật bảo toàn nguyên tố theo sơ đồ.
Một chất có hai khả năng axit - bazơ mạnh và oxi hóa - khử mạnh thì xét đồng thời
Riêng một chất khi phản ứng với chất khác mà có cả 2 khả năng phản ứng axit - bazơ và oxi hoá - khử thì được xét đồng thời (thí dụ Fe3O4 + H+ + NO3-)
Hỗn hợp gồm Mn+, H+, NO3- thì xét vai trò oxi hóa như sau (H+, NO3-), H+, Mn+
II. Bài tập hóa 10 chương 4
Câu 1: Phát biểu nào sau đây sai:
A. Trong phản ứng oxi hóa khử, chất đóng vai trò là chất oxi hóa sẽ bị khử và ngược lại.
B. Chất khử là chất có thể cho electron cho các chất khác.
C. Khử một nguyên tố là lấy bớt electron của nguyên tố đó.
D. Tính chất hoá học cơ bản của phi kim là tính khử.
Câu 2: Chỉ ra mệnh đề đúng:
A. Có phản ứng hoá học chỉ xảy ra sự khử.
B. Trong một phản ứng oxi hoá – khử không thể tồn tại một chất vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hoá
C. Sự khử và sự oxi hoá là 2 quá trình ngược nhau nhưng cùng tồn tại đồng thời trong một phản ứng oxi hoá – khử.
D. Một chất có tính khử gặp một chất có tính oxi hoá nhất định phải xảy ra phản ứng oxi hoá – khử.
Câu 3: Trong hóa học vô cơ , phản ứng hóa học nào có số oxi hóa của các nguyấn tố luôn không đổi ?
A. Phản ứng hóa hợp.
B. Phản ứng trao đổi.
C. Phản ứng phân hủy.
D. Phản ứng thế.
Câu 4: Trong hóa học vô cơ, phản ứng hóa học nào luôn là phản ứng oxi hóa – khử ?
A. Phản ứng hóa hợp.
B. Phản ứng trao đổi.
C. Phản ứng phân hủy.
D. Phản ứng thế.
Câu 5: Phương pháp thăng bằng electron dựa trên nguyấn tắc :
A. Tổng số electron do chất oxi hóa cho bằng tổng số electron mà chất khử nhận.
B. Tổng số electron do chất oxi hóa cho bằng tổng số electron chất bị khử nhận.
C. Tổng số electron do chất khử cho bằng tổng số electron mà chất oxi hóa nhận.
D. Tổng số electron do chất khử cho bằng tổng số electron mà chất bị oxi hóa nhận.
Câu 6: Trong hóa học vô cơ, loại phản ứng hóa học nào có thể là phản ứng oxi hóa – khử hoặc không phải phản ứng oxi hóa – khử ?
A. Phản ứng hóa hợp và phản ứng trao đổi.
B. Phản ứng trao đổi và phản ứng thế.
C. Phản ứng thế và phản ứng phân hủy.
D. Phản ứng phân hủy và phản ứng hóa hợp
>> Chi tiết nội dung tài liệu mời các bạn ấn vào link TẢI VỀ MIỄN PHÍ
...........................................
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Tóm tắt lý thuyết Hóa học 10 - Chương 4: Phản ứng oxi hóa - khử. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 10, Thi thpt Quốc gia môn Văn, Thi thpt Quốc gia môn Lịch sử, Thi thpt Quốc gia môn Địa lý, Thi thpt Quốc gia môn Toán, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11 mà VnDoc tổng hợp và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.





