NaNO3 + H2SO4 → HNO3 + NaHSO4
Điều chế HNO3 trong phòng thí nghiệm
NaNO3 + H2SO4 → HNO3 + NaHSO4 được VnDoc biên soạn là phương trình điều chế HNO3 trong phòng thí nghiệm, người ta đun hỗn hợp natri nitat với axit sunfuric đặc để thu được HNO3. Hy vọng thông qua nội dung dưới đây giúp bạn đọc viết và cân bằng chính xác phản ứng. Từ đó vận dụng tốt vào giải bài tập. Mời các bạn tham khảo.
1. Trong phòng thí nghiệm thường điều chế HNO3 bằng phản ứng
NaNO3 + H2SO4  \(\overset{t^{o} }{\rightarrow}\) HNO3 + NaHSO4
\(\overset{t^{o} }{\rightarrow}\) HNO3 + NaHSO4
2. Điều kiện phương trình phản ứng từ NaNO3 ra HNO3
Nhiệt độ
3. Tiến hành thí nghiệm điều chế HNO3 trong phòng thí nghiệm
Để điều chế HNO3 trong phòng thí nghiệm, người ta cho muối natri nitrat tinh thể tác dụng với axit sunfuric đặc, chưng cất hỗn hợp này tại nhiệt độ sôi của axit nitric là 83oC cho đến khi còn lại chất kết tinh màu trắng theo phương trình như sau:
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
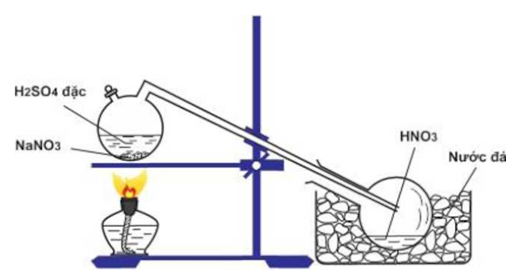
Axit nitric thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó
4. Bài tập vận dụng liên quan
Câu 1. Để điều chế HNO3 trong phòng thí nghiệm người ta điều chế từ
A. NaNO3, H2SO4 đặc
B. NaNO3, N2, H2, HCl
C. N2 và H2
D. AgNO3, HCl
Để điều chế HNO3 trong phòng thí nghiệm người ta điều chế từ NaNO3, H2SO4 đặc
Phương trình phản ứng minh họa
NaNO3 (rắn) + H2SO4 (đặc) → HNO3 + NaHSO4
Câu 2. Phát biểu nào sau đây là sai khi nói về quá trình điều chế Axit nitric?
A. Axit nitric có nhiệt độ sôi thấp ( 83oC) nên dễ bị bay hơi khi đun nóng.
B. Axit nitric là axit yếu hơn axit sufuric nên bị đẩy ra khỏi muối.
C. Axit nitric thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó.
D. Đốt nóng bình cầu bằng đèn cồn để phản ứng xảy ra nhanh hơn.
Câu 3. Sơ đồ đúng để điều chế HNO3 trong công nghiệp là:
A. N2 → NH3 → NO → NO2 → HNO3.
B. N2 → NH3 → NO → NO2 → HNO3.
C. NH4NO2 → NO → N2O5 → HNO3.
D. N2 → NH3 → NO → N2O5 → HNO3.
Sơ đồ đúng để điều chế HNO3 trong công nghiệp là: N2 → NH3 → NO → NO2 → HNO3.
Phương trình hóa học minh họa
N2 + 3H2 ![]() \(\overset{t^{o},p }{\rightleftharpoons}\) 2NH3
\(\overset{t^{o},p }{\rightleftharpoons}\) 2NH3
4NH3 + 5O2![]() \(\overset{t^{o} }{\rightarrow}\)4NO + 6H2O
\(\overset{t^{o} }{\rightarrow}\)4NO + 6H2O
2NO + O2 ![]() \(\overset{t^{o} }{\rightarrow}\) 2NO2
\(\overset{t^{o} }{\rightarrow}\) 2NO2
4NO2 + O2 + 2H2O ![]() \(\overset{t^{o} }{\rightarrow}\) 4HNO3
\(\overset{t^{o} }{\rightarrow}\) 4HNO3
Câu 4. Khi bị nhiệt phân, dãy muối nitrat nào sau đây dều cho sản phẩm là kim loại, khí nitơ đioxit và khí Oxi
A. Zn(NO3)2, NaNO3, Pb(NO3)2
B. Cu(NO3)2, NaNO3, KNO3
C. Ba(NO3)2, LiNO3, KNO3
D. Hg(NO3)2, AgNO3
Nhiệt phân cho sản phẩm kim loại, khí nitơ đioxit và khí oxi là kim loại nhóm III.
Phương trình hóa học
Hg(NO3)2 ![]() \(\overset{t^{o} }{\rightarrow}\)Hg + 2NO2↑ + O2↑
\(\overset{t^{o} }{\rightarrow}\)Hg + 2NO2↑ + O2↑
2AgNO3 ![]() \(\overset{t^{o} }{\rightarrow}\) 2Ag + 2NO2↑ + O2↑
\(\overset{t^{o} }{\rightarrow}\) 2Ag + 2NO2↑ + O2↑
=> dãy muối cho sản phẩm kim loại, khí nitơ đioxit và khí oxi là: Hg(NO3)2, AgNO3
Câu 5. Khí nitơ có thể được tạo thành từ phản ứng hóa học nào sau đây?
A. Đốt cháy NH3 trong oxi có chất xúc tác platin
B. Nhiệt phân NH4NO3
C. Nhiệt phân AgNO3
D. Nhiệt phân NH4NO2
..........................
Trên đây VnDoc.com vừa giới thiệu tới các bạn phương trình hóa học NaNO3 + H2SO4 → HNO3 + NaHSO4, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa lớp 12. Mời các bạn cùng tham khảo thêm các môn Ngữ văn 12, Tiếng Anh 12, Thi thpt Quốc gia môn Toán, Thi THPT Quốc gia môn Vật Lý,....
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook: Tài Liệu Học Tập VnDoc.com. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.









