NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O
Điều chế NH3 trong phòng thí nghiệm
NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O được VnDoc biên soạn là phương trình điều chế amoniac trong phòng thí nghiệm có công thức hóa học là NH3. Hy vọng sẽ giúp ích cho các bạn học sinh trong quá trình học tập cũng như làm các dạng bài tập. Mời các bạn tham khảo.
1. Phương trình điều chế NH3 trong phòng thí nghiệm
2NH4Cl + Ca(OH)2  \(\overset{t^{\circ } }{\rightarrow}\) CaCl2 + 2NH3 ↑ + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) CaCl2 + 2NH3 ↑ + 2H2O
2. Điều kiện phương trình phản ứng NH4Cl ra NH3
Nhiệt độ
3. Phương trình ion rút gọn NH4Cl + Ca(OH)2
Phương trình phân tử phản ứng NH4Cl + Ca(OH)2
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 ↑ + 2H2O
Phương trình ion thu gọn NH4Cl + Ca(OH)2
NH4+ + OH−→ NH3 + H2O
3. Trong phòng thí nghiệm người ta có thể thu khí NH3 bằng phương pháp
Sử dụng phương pháp thu khí bằng cách đẩy không khí, vì khối lượng phân tử của amoniac nhẹ hơn khối lượng của không khí.
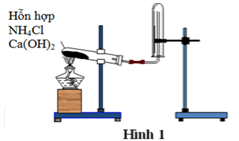
Lưu ý khi điều chế amoniac:
Làm khô khí bằng CaO. Để điều chế một lượng nhỏ NH3 thì đun nóng dung dịch NH3 đậm đặc
4. Bài tập vận dụng liên quan Amoniac
Câu 1. Trong phòng thí nghiệm người ta có thể điều chế khí NH3 bằng cách
A. đẩy nước
B. chưng cất
C. đẩy không khí với miệng bình ngửa
D. đẩy không khí với miệng bình úp ngược
Câu 2. Dung dịch amoniac có thể tác dụng được với các dung dịch nào dưới đây
A. HCl, BaCl2
B. NaNO3, H2SO4
C. Fe(NO3)3, AlCl3
D. Ca(NO3)2, HNO3
Câu 3. Khi nói về muối amoni, phát biểu nào dưới đây không đúng:
A. Muối amoni là muối của NH3 với axit.
B. Tất cả các muối amoni đều tan và là những chất điện li mạnh
C. Muối amoni còn dễ bị phân hủy bởi nhiệt
D. Dung dịch muối amoni có tính chất bazơ
Câu 4. Cho các oxit: Na2O, BaO, Al2O3, CuO, PbO, FeO. Có bao nhiêu oxit bị khí NH3 khử ở nhiệt độ cao?
A. 1
B. 2
C. 3
D. 4
Câu 5. Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch
A. Axit nitric và đồng (II) nitrat
B. Đồng (II) nitrat và amoniac
C. Barihidroxit và axit photphoric
D. Amoni hidrophotphat và kalihidroxit
Câu 6. Trong dãy nào sau đây tất cả các muối đều ít tan trong nước?
A. AgNO3, K3PO4, CaHPO4, CaSO4
B. AgCl, PbS, Ca(H2PO4)2, Ca(NO3)2
C. AgI, CuS, CaHPO4, Ca3(PO4)2
D. AgF, CuSO4, CaCO3, Ca(H2PO4)2
Câu 7. Nhận xét nào là không đúng khi nói về muối nitrat của kim loại
A. Tất cả các muối nitrat đều dễ tan trong nước
B. Các muối nitrat đều là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat.
C. Các muối nitrat đều dễ bị phân hủy bởi nhiệt
D. Các muối nitrat chỉ được sử dụng làm phân bón hóa học trong nông nghiệp.
Câu 8. Cho 3,84 gam Cu vào 100 ml dung dịch gồm HNO3 0,6M và H2SO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là:
A. 20,16 gam.
B. 19,76 gam.
C. 19,20 gam.
D. 9,88 gam
Ta có:
nCu = 0,06 mol;
nHNO3 = 0,06 mol;
nH2SO4 = 0,05 mol;
nH+ = nHNO3 + 2.nH2SO4 = 0,06 + 2.0,06 = 0,16 mol
Phương trình ion thu gọn xảy ra:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Ban đầu: 0,06 0,16 0,06 dư)
Phản ứng: 0,06 0,16 → 0,04 → 0,06 → 0,04
Sau: 0 0 0,02 0,06
Xét tỉ lệ ta có: Do 0,06/3 = 0,16/8 < 0,06/2 nên Cu và H+ hết; NO3-
Dung dịch muối thu được chứa: 0,12 mol Cu2+; 0,02 mol NO3- dư và 0,1 mol SO42-
=> mmuối khan = 0,06. 64 + 0,02. 62 + 0,05.96 = 9,88 gam
Câu 9. Trong những nhận xét dưới đây về muối amoni, nhận xét nào đúng?
A. Muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion hiđroxit.
B. Tất cả các muối amoni đều dễ tan trong nước, khi tan phân li hoàn toàn thành cation amoni và anion gốc axit.
C. Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hoá đỏ.
D. Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra.
A sai vì muối amoni là tinh thể ion, phân tử gồm cation amoni và anion gốc axit
C sai vì khí làm quì hóa xanh
D sai vì khi nhiệt phân muối amoni chưa chắc ra khi amoniac.
Thí dụ
NH4NO2 → N2 + 2H2O
Câu 10. Amoniac phản ứng được với tất cả các chất trong nhóm nào sau đây (các điều kiện coi như có đủ)
A. HCl, O2, Cl2, CuO, dung dịch AlCl3
B. H2SO4, PbO, FeO, NaOH
C. HCl, KOH, FeCl3, Cl2
D. KOH, HNO3, CuO, CuCl2
NH3 có tính bazơ nên không phản ứng được với bazơ mạnh
=>NaOH, KOH không phản ứng với NH3 loại B, C, D
................................
Trên đây VnDoc.com vừa giới thiệu tới các bạn bài viết NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O, mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học lớp 11. Mời các bạn cùng tham khảo thêm kiến thức các môn Toán 11, Ngữ văn 11, Tiếng Anh 11, đề thi học kì 1 lớp 11, đề thi học kì 2 lớp 11...
Để tiện trao đổi, chia sẻ kinh nghiệm giảng dạy và học tập môn học THPT, VnDoc mời các bạn truy cập nhóm riêng dành cho lớp 11 sau: Nhóm Tài liệu học tập lớp 11 để có thể cập nhật được những tài liệu mới nhất.









