NO2 + O2 + H2O → HNO3
NO2 ra HNO3: NO2 O2 H2O HNO3
NO2 + O2 + H2O → HNO3 là phản ứng hóa học được VnDoc biên soạn hướng dẫn bạn đọc viết phương trình NO2 ra HNO3.
>> Mời các bạn tham khảo thêm một số phương trình liên quan
- NH3 + HNO3 → NH4NO3
- NH3 + Cl2 → N2 + NH4Cl
- NH3 + O2 → NO + H2O
- NH3 + HCl → NH4Cl
- NH3 + H2O → NH4OH
- NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl
- NH4Cl + AgNO3 → NH4NO3 + AgCl
- NH4Cl + NaOH → NH3 + H2O + NaCl
1. Phương trình phản ứng NO2 ra HNO3
4NO2 + O2 + 2H2O → 4HNO3
2. Điều kiện để NO2 ra HNO3
Không có
3. Cách tiến hành phản ứng để NO2 ra HNO3
Cho NO2 tác dụng với O2 và hơi nước trong không khí
4. Hiện tượng phản ứng hóa học xảy ra
Khi cho NO2 tác dụng với O2 và hơi nước tạo ra axit nitric
5. Mở rộng kiến thức về NO2 (nitơ đioxit)
5.1 Khí NO2 là gì?
Công thức hóa học: NO2.
Khí NO2 hay có tên gọi khác là nitrit, khí nitơ đioxit hay điôxít nitơ. Nó là một trong các loại oxit nito.
Khí NO2 có màu nâu đỏ có mùi gắt rất đặc trưng. Vì thế khí NO2 có mùi dễ nhận biết hơn so với các khí độc khác và dễ dàng phát hiện ra nếu có rò rỉ.
5.2. Tính chất hóa học của NO2
NO2 tham gia vào phản ứng oxy hóa khử:
3NO2 + H2O → 2HNO3 + NO
(Trong phản ứng này ta thấy NO2 vừa là chất oxy hóa vừa là chất khử).
NO2 tham gia vào phản ứng quang hóa trong điều chế NO
NO2 + hv (λ < 430 nm) → NO + O
6. Bài tập vận dụng liên quan
Câu 1. Quá trình nào dưới đây không làm giảm lượng oxi trong không khí?
A. Sự gỉ của các vật dụng bằng sắt ngoài không khí
B. Sự quang hợp của cây xanh trong tự nhiên
C. Sự cháy của than, củi, bếp ga
D. Sự hô hấp của động vật con người
Quá trình không làm giảm lượng oxi trong không khí là: Sự quang hợp của cây xanh.
Vì sự quang hợp của cây xanh là quá trình sản sinh ra khí oxi
Câu 2. Trong công nghiệp bằng cách nào sau đây để sản xuất khí nitơ?
A. Chưng cất phân đoạn không khí lỏng
B. Nhiệt phân NH4NO3
C. Dùng phương pháp dời nước
D. Nhiệt phân muối amoni clorua NH4Cl
Điều chế nito trong công nghiệp (cũng giống oxi) là chưng cất phân đoạn không khí lỏng, hạ nhiệt độ rất thấp để hóa lỏng không khí, loại tạp chất rồi tăng dần để thu N2 và O2
Câu 3. Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng sẵn dung dịch Al2(SO4)3. Hiện tượng quan sát được trong quá trình phản ứng là:
A. Có kết tủa keo trắng xuất hiện, sau đó kết tủa lại tan dần
B. Có kết tủa keo màu trắng xuất hiện
C. Có kết tủa màu xanh lục xuất hiện, sau đó kết tủa lại tan dần
D. Có kết tủa màu xanh lục xuất hiện
Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng sẵn dung dịch Al2(SO4)3 thấy xuất hiện
6NH3 + Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
Xuất hiện kết tủa trắng
Câu 4. Oxit phi kim nào dưới đây không phải là oxit axit?
A. CO2
B. N2O5
C. P2O5
D. NO
Câu 5. Dãy kim loại nào dưới đây không phản ứng với HNO3 đặc nguội
A. Al, Zn, Fe
B. Al, Cr, Fe
C. Cu, Ag, Cr
D. Cu, Cr, Fe
Dãy kim loại nào dưới đây không phản ứng với HNO3 đặc nguội
Loại A. vì Zn phản ứng với HNO3 đặc nguội
Đúng B vì Al, Cr, Fe không phản ứng với HNO3 đặc nguội
Loại C vì Cu, Ag phản ứng với HNO3 đặc nguội
Loại D vì Cu phản ứng với HNO3 đặc nguội
Câu 6. Sau cơn mưa người ta thường cảm thấy không khí trong lành hơn vì:
A. Mưa kéo theo những hạt bụi làm giảm lượng bụi trong không khí.
B. Trong khi mưa có sấm sét là điều kiện để tạo ra lượng nhỏ ozon có tác dụng diệt khuẩn.
C. Sau cơn mưa cây cối quang hợp mạnh hơn.
D. Cả A, B.
Sau cơn mưa người ta thường cảm thấy không khí trong lành hơn vì:
A. Mưa kéo theo những hạt bụi làm giảm lượng bụi trong không khí.
B. Trong khi mưa có sấm sét là điều kiện để tạo ra lượng nhỏ ozon có tác dụng diệt khuẩn.
Câu 7. Nhận định đúng về phản ứng điều chế HNO3 trong phòng thí nghiệm bằng phản ứng
NaNO3 + H2SO4 → HNO3 + NaHSO4.
A. có thể dùng axit sunfuric loãng.
B. có thể thay thế natri nitrat bằng kali nitrat.
C. axit nitric thu được ở dạng lỏng không cần làm lạnh.
D. đây là phản ứng oxi hóa khử.
A sai vì không thể dùng axit sunfuric loãng.
B đúng vì có thể thay thế natri nitrat bằng kali nitrat.
C sai vì axit nitric dễ bay hơi nên thu được hơi HNO3.
D sai vì đây là phản ứng trao đổi vì không làm thay đổi số oxi hóa.
Câu 8. Đem nung hỗn hợp A gồm: x mol Fe và 0,15 mol Cu, trong không khí một thời gian, thu được 63,2 gam hỗn hợp B, gồm hai kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp B trên bằng dung dịch HNO3 đậm đặc, thì thu được 0,6 mol NO2. Trị số của x là:
A. 0,7 mol
B. 0,6 mol
C. 0,5 mol
D. 0,4 mol
nO = y mol; nFe = x mol
56x + 0,15.64 + 16y = 63,2 (1);
3x + 0,15.2 = 2y + 0,6 (2)
Từ 1, 2 => x = 0,7 và y = 0,9
Câu 9. Đốt cháy 11,2 gam bột Fe trong bình đựng O2 thu được 14,72 gam hỗn hợp X gồm Fe2O3, Fe3O4 và Fe. Hòa tan hoàn toàn lượng hỗn hợp X bằng dung dịch HNO3 thu được V lít hỗn hợp khí Y gồm NO và NO2. Tỉ khối của B so với H2 bằng 19. Thể tích V ở đktc là:
A. 1792 ml
B. 672 ml.
C. 448 ml.
D. 896 ml.
MX = 19.2 = 38
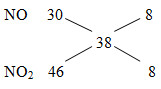
=> nN2 = nNO2 = x
mFe + mO = moxit
=> mO = moxit - mFe = 14,72 - 11,2 = 3,52 gam
=> nO = 0,22 mol
Fe0 → Fe3+ + 3e
0,2 → 0,6
O0 + 2e →O2-
0,22 → 0,44
N+5 + 3e → N+2
3x x
N+5 +1e → N+4
x x
Bảo toàn e: 0,6 = 0,44 + 3x + x =0,44+4x => x= 0,04
=> nkhí = 2x = 0,08 mol
=> Vkhí = 0,08.22,4 = 1,792 lít = 1792 ml
Câu 10. Cho 30 gam hỗn hợp X gồm: Fe; FeO; Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư được 5,6 lít khí NO (đktc, sp khử duy nhất) và dung dịch Y. Số mol của HNO3 đã phản ứng là:
A. 1 mol
B. 1,45 mol
C. 1,6 mol
D. 1,35 mol
Quy đổi 30 gam hỗn hợp X thành Fe, và O. Gọi x, y lần lượt là số mol của Fe và O =>
56x + 16y = 30 (1);
3x – 2y = 0,25.3 (2);
Từ 1, 2 => x = 0,45 và y = 0,3; nHNO3 = 4.nNO + 2nO = 4.0,25 + 2.0,3 = 1,6 mol
Câu 11. Chỉ dùng H2O và điều kiện đun nóng có thể tách hổn hợp nào sau đây?
A. NH4Cl, K2CO3, KCl
B. NH4NO3, CaCO3, Na2SO4
C. NH4Cl, CaSO4, MgSO4
D. Tất cả đều thực hiện được
Chỉ dùng H2O và điều kiện đun nóng có thể tách hổn hợp: NH4Cl, CaSO4, MgSO4
Ta có NH4Cl, MgSO4 tan => Nhận ra CaSO4
Nung dung dịch chứa hai chất kia, NH4Cl phân hủy ra NH3, HCl nên thu được MgSO4.
Còn NH3, HCl, cho tái tại amoni là được NH4Cl.
Câu 12. Cho 150 ml dung dịch KOH 1M tác dụng với 200 ml dung dịch H3PO4 0,5M. Sau phản ứng, trong dung dịch chứa các muối
A. KH2PO4 và K2HPO4.
B. KH2PO4 và K3PO4.
C. K2HPO4 và K3PO4.
D. KH2PO4, K2HPO4 và K3PO4
Ta có:
nKOH = 0,15 (mol); nH3PO4 = 0,1 (mol)
Ta thấy: 1 < nKOH/ nH3PO4 = 0,15/0,1 = 1,5 < 2 → Tạo muối KH2PO4 và K2HPO4
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
Câu 13. Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là :
A. Khí màu nâu bay lên, dung dịch chuyển màu xanh
B. Khí không màu bay lên, dung dịch chuyển màu xanh
C. Khí không màu bay lên, dung dịch có màu nâu
D. Khí thoát ra không màu hoá nâu trong không khí, dung dịch chuyển sang màu xanh
Cho kim loại Cu tác dụng với HNO3 đặc hiện tượng quan sát được là: Khí màu nâu bay lên, dung dịch chuyển màu xanh
Phương trình phản ứng
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Câu 14. Hòa tan hết m gam FeS bằng một lượng tối thiểu dung dịch HNO3 (dung dịch X), thu được dung dịch Y và khí NO. Dung dịch Y hòa tan tối đa 1,92 gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Số mol HNO3 trong X là
A. 0,48.
B. 0,12.
C. 0,36.
D. 0,24.
nCu = 0,03 mol
Ta có: 2Fe3+ + Cu → 2Fe2+ + Cu2+
=> nFe3+(Y) =0,6 mol => nFeS = 0,6 mol
FeS → Fe3+ + S+6 + 9e
N+5 + 3e → N+2
=> Bảo toàn e: nNO =3.nFe3+ = 0,18 mol
Dung dịch Y chứa Fe2(SO4)3 và Fe(NO3)3
Bảo toàn nguyên tố S: nFe2(SO4)3 =1/3.nFeS = 0,02 mol
Bảo toàn nguyên tố Fe và S :
nFeS = 2.nFe2(SO4)3 + nFe(NO3)3
=> nFe(NO3)3= 0,06 − 2.0,02 = 0,02 => nNO − 3nNO3− muối = 0,06 mol
Bảo toàn nguyên tố N: nHNO3 = nNO + nNO3− muối = 0,36 + 0,12 = 0,24 mol
Câu 15. Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
C. có kết tủa keo trắng, không thấy kết tủa tan.
D. dung dịch trong suốt.
Dẫn NH3 vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
=> Hiện tượng: Có kết tủa keo trắng không tan
Câu 16. Dãy các chất nào sau đây tác dụng với HNO3 đặc nóng đều xảy ra phản ứng oxi hóa khử là
A. Fe, FeO, Fe(OH)2, Fe(OH)3
B. Fe, FeO, Fe(NO3)2, FeCO3
C. Fe, FeSO4, Fe2(SO4)3, FeCO3
D. Fe, FeO, Fe(NO3)2, Fe(NO3)3
Phản ứng oxi hóa khử xảy ra khi Fe trong hợp chất chưa đạt số oxi hóa tối đa
Mà trong Fe(OH)3 , Fe2(SO4)3, Fe(NO3)3 sắt có số oxi hóa +3 => A, C, D sai
Phương trình phản ứng minh họa cho đáp án đúng
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe(NO3)2 + 2 HNO3 → Fe(NO3)3 + NO2 + H2O
FeCO3 + 4 HNO3 → Fe(NO3)3 + CO2 + NO2 + 2 H2O
Câu 17. Hãy cho biết dãy hóa chất nào sau đây khi phản ứng với HNO3 đặc nóng đều thu được khí NO2 bay ra?
Fe2O3, CuS, NaNO2, NaI.
...............................









